Come migliorare i fattori predittivi per gestire in maniera corretta i tessuti parodontali coinvolti nelle chirurgie odontostomatologiche.
Introduzione
Nel contesto delle malattie parodontali, la parodontite è un’infiammazione cronica causata da specifici agenti patogeni contenuti nella placca dentale che porta a una disbiosi ospite/batteri con la conseguente distruzione del tessuto connettivo, riassorbimento osseo e perdita dei denti1. Essa rappresenta la sesta malattia cronica non trasmissibile più diffusa al mondo2 e la causa principale di perdita dei denti. La parodontite, nelle sue diverse forme, mostra un’elevata prevalenza (oltre il 40%) tra gli individui che vivono nei Paesi industrializzati, mentre le forme più gravi coinvolgono stabilmente più del 10% della popolazione mondiale3, 4 con notevoli problemi estetici, masticatori e psicologici nei pazienti affetti. È importante ricordare che le conseguenze della parodontite hanno un impatto non solo da un punto di vista sanitario ma anche socio-economico, con dei costi complessivi da essa generati che, nei Paesi europei, si avvicinano a quelli determinati da importanti malattie sistemiche5. La parodontite ha il picco di incidenza intorno ai 40 anni e affligge, in modo significativo, le classi sociali meno abbienti creando un’ulteriore disuguaglianza nella possibilità di accedere alle cure, che nel nostro Paese sono per oltre il 90% a carico del cittadino. Fattori di rischio riconosciuti per queste patologie sono il fumo, il diabete non compensato, lo stress, l’obesità e la predisposizione genetica6.
La parodontite riveste un crescente interesse anche in ambito medico, poiché diversi dati dimostrano come essa interagisca con molte malattie sistemiche, comprese le malattie cardiovascolari e il diabete7. I meccanismi ipotetici alla base di queste interazioni si basano sull’infiammazione sistemica determinata dalla parodontite con la produzione di molecole pro-infiammatorie e la liberazione di tossine batteriche a livello sistemico, in grado di alterare, complicandolo, il profilo di malattie croniche già in atto7. Queste associazioni sono supportate da diversi studi di intervento che dimostrano come il trattamento della parodontite migliori il profilo di rischio cardiovascolare8 e il compenso diabetico9.
Recentemente, il World Workshop congiunto della European Federation of Periodontology e dell’American Academy of Periodontology ha introdotto la nuova classificazione delle malattie parodontali, descrivendo per la parodontite quattro stadi progressivi di malattia (da I a IV) per identificare severità ed estensione della patologia10. La recente classificazione introduce anche tre gradi di malattia (A, B, C) che definiscono il potenziale rischio individuale di progressione della patologia10. Tale classificazione, in linea con i criteri classificativi di altre discipline mediche, mira a standardizzare un modello diagnostico coerente per inquadrare una strategia terapeutica personalizzata per il paziente.
Alla luce dei moderni progressi scientifici in parodontologia, si è sentita la necessità di produrre e implementare linee guida cliniche che forniscano raccomandazioni per il trattamento della parodontite al fine di garantire un razionale iter terapeutico per i pazienti e assicurare l’appropriatezza degli interventi preventivi e terapeutici al variare dello stadio e del grado della malattia11. La scelta di questi interventi deve essere fatta seguendo un rigoroso processo decisionale basato sull’evidenza scientifica. In accordo con le Linee Guida EFP11, il trattamento delle parodontiti, mucositi peri-implantari dovrebbe includere tools come curettes in titanio, punte ultrasoniche in polietereterchetone o dispositivi di air-polishing con polveri di glicina.
Al fine di prevenire la formazione del biofilm alla superficie implantare, l’aggiunta di antibiotici locali o antisettici sembra implementare ulteriormente la risposta al trattamento. La clorexidina è un bisguanide cationico con una attività antibatterica ad ampio spettro, agendo sui batteri G+, G-, virus e lieviti. Le caratteristiche che attualmente permettono di definire la Clorexidina come gold standard tra gli agenti antisettici presenti in commercio sono la sua substantività e i suoi prolungati effetti antimicrobici sulle mucose e sulla superficie del dente, oltre che le sue proprietà battericide e batteriostatiche12. Il gel a base di Clorexidina e Xantano (Chlosite, Ghimas) è costituito da Clorexidina (CHX) digluconata (0.5%), Clorexidina (CHX) diidroclorica (1%) in rapporto 1:2 e da gel Xantano (0.5%). Quest’ultimo è un polimero che forma un reticolo tridimensionale pseudo-plastico con l’acqua, un ottimo substrato per la formazione di un gel stabile, permettendo un rilascio prolungato di Clorexidina. Tale gel esplica la propria funzione per circa 30 giorni. La Clorexidina digluconata viene liberata al momento dell’applicazione, raggiungendo una concentrazione > 100 μg/ml, che permane per circa 6-9 giorni (si tenga in considerazione che la concentrazione minima inibente - MIC - per tale antimicrobico è pari a 0.10 μg/ml). La Clorexidina diidroclorica, invece, viene rilasciata nei giorni successivi, permettendo un’azione batteriostatica e battericida per le successive due settimane e prevenendo una possibile ricolonizzazione del sito. Sebbene l’utilizzo di agenti antimicrobici potrebbe non essere efficace nel trattamento della malattia parodontale e peri-implantare, l’utilizzo del gel a base di Xantano e Clorexidina (CHX-XAN) in aggiunta al trattamento parodontale non chirurgico ha riportato miglioramenti clinici tali per cui si può giustificare il suo utilizzo nel trattamento della parodontite13-15. Studi suggeriscono come l’utilizzo del gel a base di Xantano e Clorexidina possa migliorare i parametri clinici parodontali: una revisione sistematica16 ha concluso che l’aggiunta di questo gel apporti benefici in termini di riduzione della profondità di sondaggio rispetto alla sola terapia non chirurgica.
L’obiettivo del presente studio è descrivere un piano di trattamento efficace nel management delle patologie parodontali e peri-implantari attraverso l’utilizzo del XAN-CHX gel, in modo da preparare i tessuti al trattamento chirurgico e quindi intervenire sui siti candidati al trattamento con tessuti aventi una consistenza adeguata per sostenere tutte le tecniche oggi presenti nel panorama odontoiatrico così da ridurre al minimo ogni possibile rischio di fallimento. Una delle problematiche che affligge la rigenerativa parodontale è la recessione post-chirurgia: diverse scuole Universitarie consigliano di preparare il paziente tramite un trattamento di debridement prechirurgico sopragengivale-subgengivle migliorando così la qualità dei tessuti e predisponendoli al successivo trattamento chirurgico-rigenerativo. Il gel di XAN-CHX coadiuva questa fase aiutando e migliorando la qualità dei tessuti candidati alle chirurgie successive. L’ausilio quindi del gel di XAN-CHX consente di migliorare la predicibilità dei trattamenti parodontali-implantari oltre che prevenire l’insorgenza della peri-implantite e promuovere la restitutio ad integrum dei tessuti coinvolti12-14, 17- 20.
Materiali e metodi
Case report
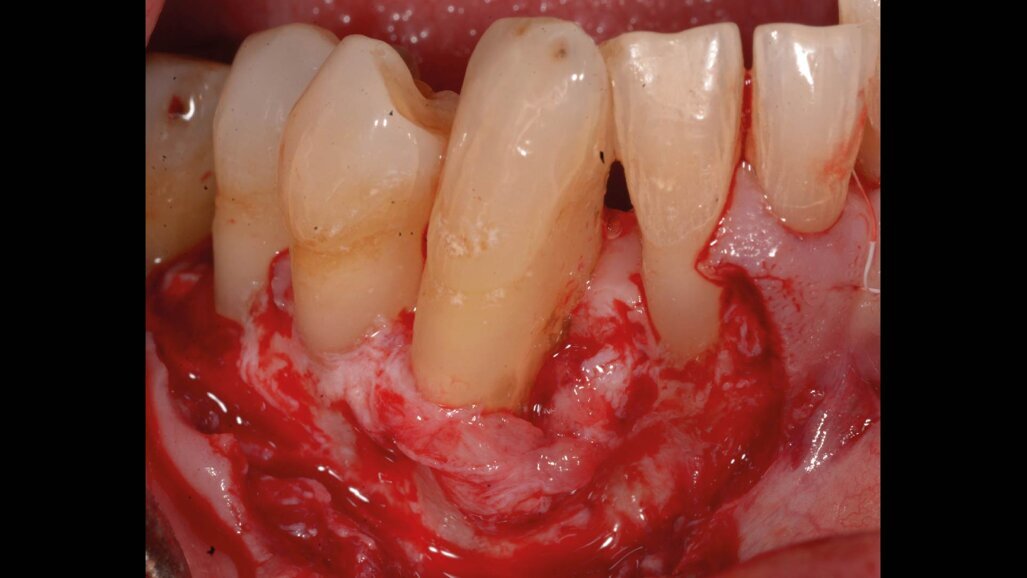
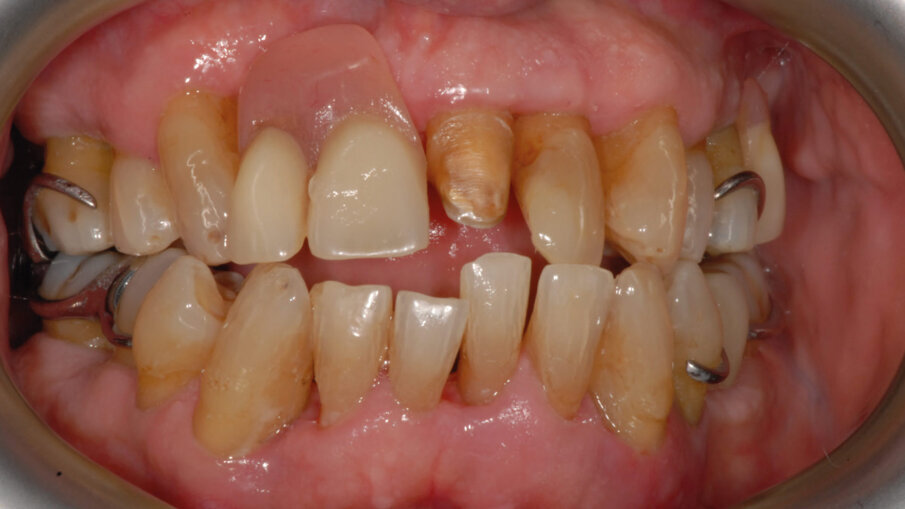
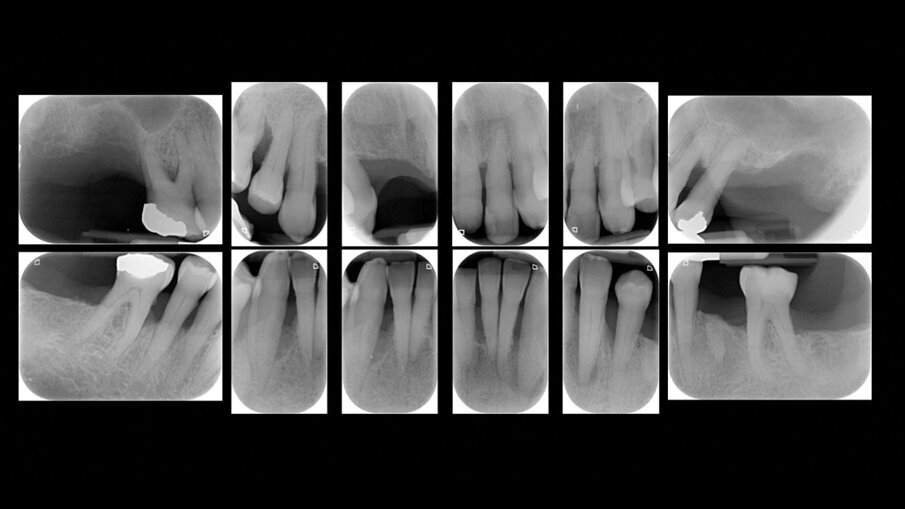
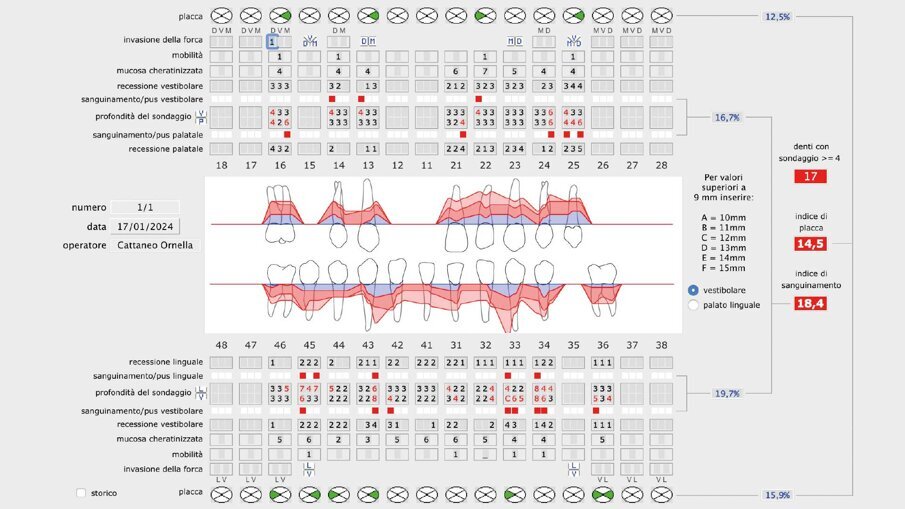
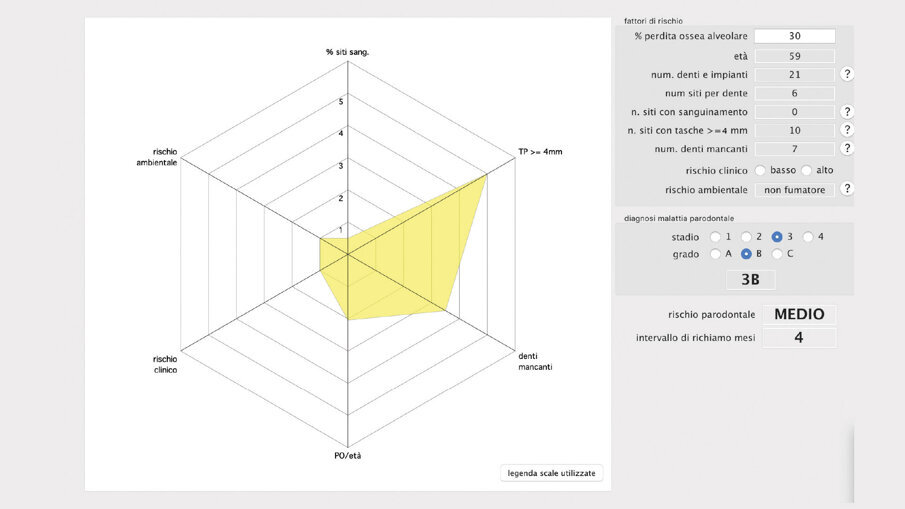
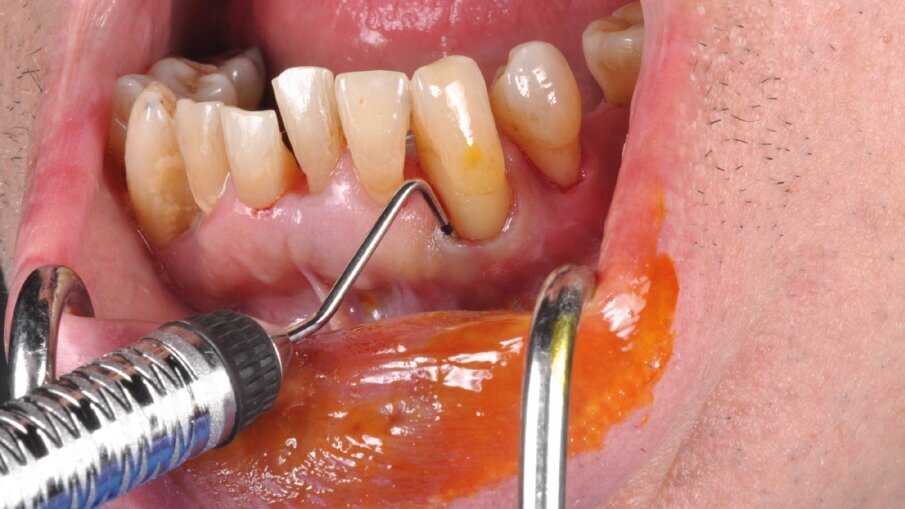
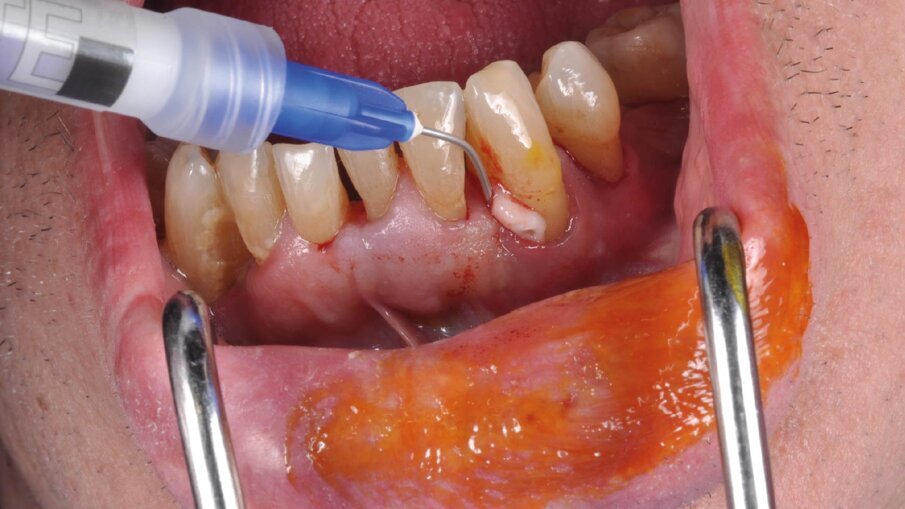
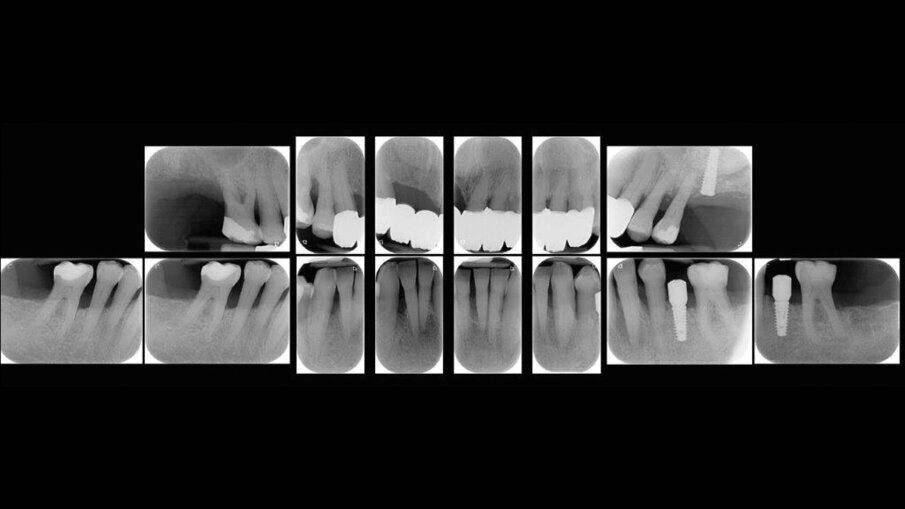
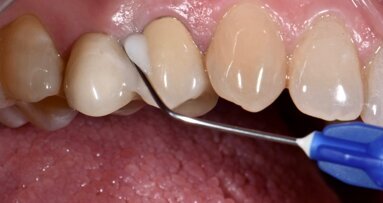
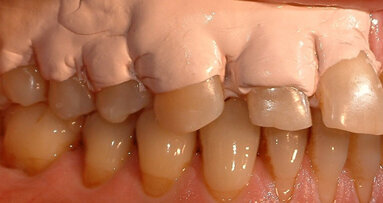
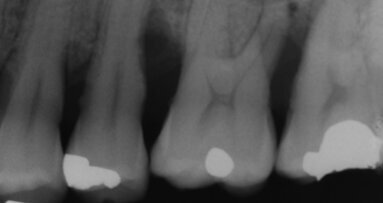
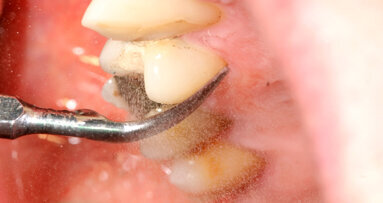
Il presente case report è stato redatto in accordo con il CARE checklist. Un paziente italiano di 59 anni, non fumatore si è recato presso il mio studio (Studio Farina srl) di Fiorano al serio (BG) nel mese di Gennaio 2023 lamentando sanguinamento gengivale sia durante lo spazzolamento, sia presenza di sangue sulla federa del cuscino dopo il sonno notturno. Inoltre il paziente ha perso diversi elementi dentari negli anni, sopperiti con due scheletrati superiore e inferiore, oggi non più congrui (Figg. 1a, 1b). All’esame intraorale si evidenziava scarsa igiene orale e la perdita della corona in zona 21. I parametri biometrici parodontali al baseline sono stati riportati. Il Paziente viene definito secondo la nuova classificazione del 2018 Stadio III grado B21 (Figg. 2, 3). Il piano di trattamento secondo le linee guida S310, 21, 22 consiste nel stabilizzare i parametri biometrici effettuando al primo livello: charting seguito da full mouth debridement caratterizzato da ablazione del tartaro tramite strumenti a ultrasuoni e strumenti manuali. Vengono subito eliminati i denti definiti persi (17, 27, 35). A 6 settimane dal livello 1 si effettua il secondo charting (Figg. 4, 5) dove si decide (livello 2) di eseguire dei OPD (open flap debridement) zona Q1, Q2, Q3, Q4 soffermandosi sui due canini 33 e 43 dove effettuare due GTR (guided tissue regeneration). Al livello 3 si effettua il posizionamento IOI (impianto osteointegrato) zona 26 (previo aumento dell’osso nel seno mascellare) e zona 35. Anteriormente si è deciso, visto la stabilità dei denti presenti e attigui all’endentulia intercalata, una volta che i denti presentano i parametri biometrici che sono rientrati nella norma, di riabilitare gli elementi persi 12, 11 non tramite scheletrato, bensì mediante ponte da 13 a 21, 22, 23 così da ridare nuova forma ai denti estremamente ricostruiti da precedenti trattamenti. Proprio durante il passaggio dal livello 1 al livello 2 si è deciso di utilizzare il gel di XAN-CHX per migliorare la qualità dei tessuti parodontali presenti in zona 33, 43 così da predisporre i siti del paziente alla successiva chirurgia rigenerativa parodontale migliorando così la predicibilità del trattamento (Figg. 6, 7).
Risultati
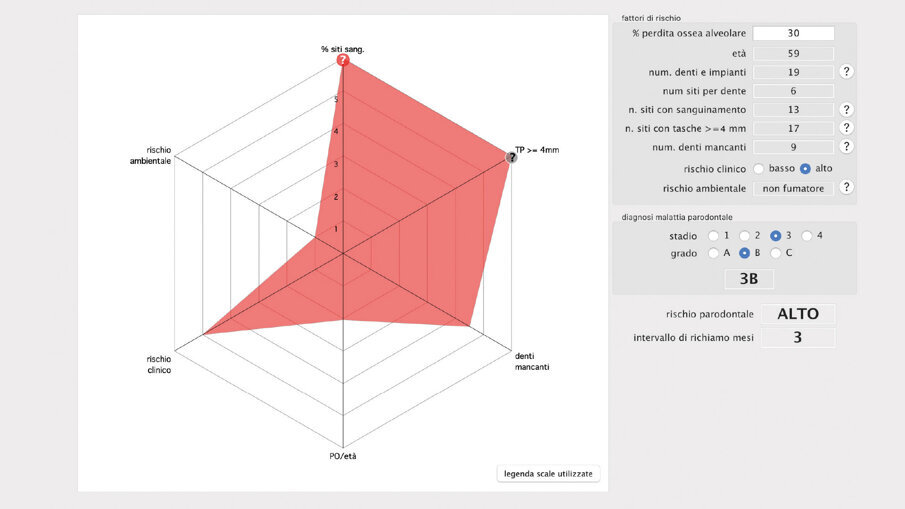
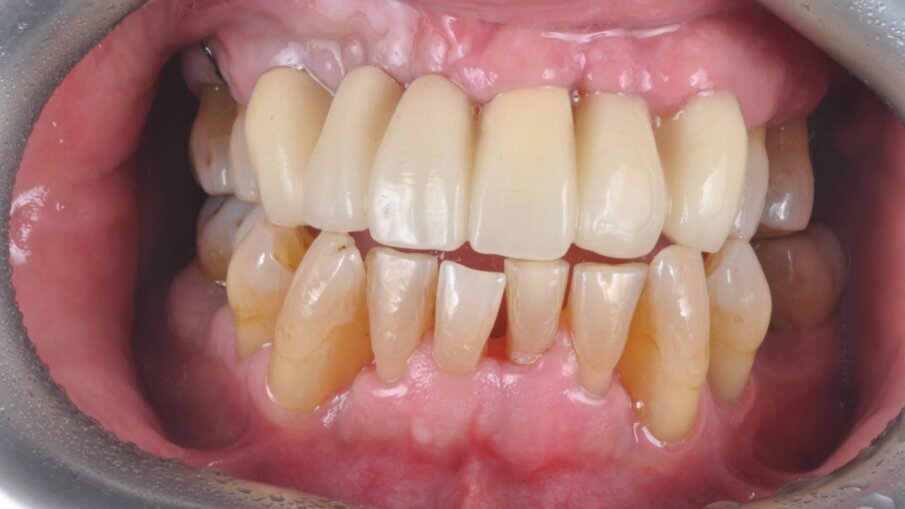
Il paziente ha migliorato la sua compliance sull’igiene domiciliare, modificato il suo stile di vita aggiungendo dello sport nella sua vita quotidiana (appena entrato in regime pensionistico). I parametri biometrici sono rivalutati sia a fine del livello 1 (rivalutazione della terapia causale) sia alla fine del piano terapeutico in modo da valutare il miglioramento delle sue condizioni di salute orale. Il Paziente è passato da un grado di rischio alto a un grado di rischio medio (valore influenzato dalla perdita iniziale importante di osso causato dalla malattia parodontale) perché se guardassimo solo agli indici biometrici sarebbe a rischio basso.
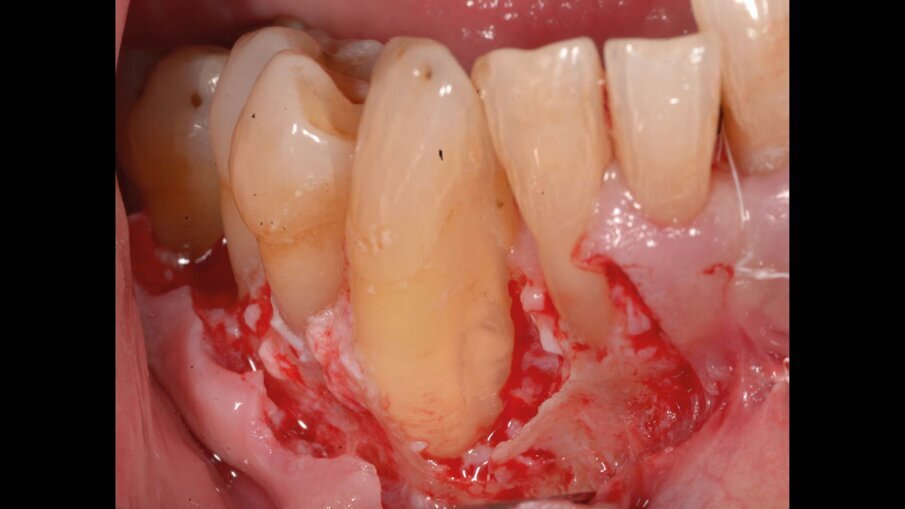
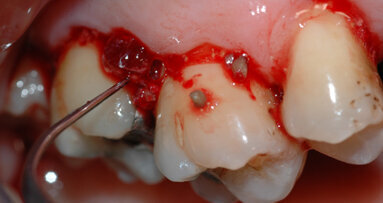
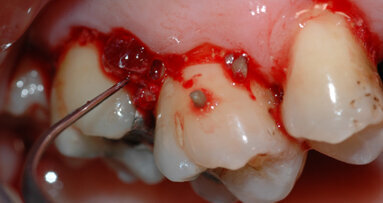
Il paziente ha effettuato durante il livello 2 degli OPD che hanno ridotto la profondità di tasca a scapito di una piccola quota di aumento della recessione, esito in parte compensato dall’effetto rebound dei tessuti dopo la chirurgia resettiva (ove necessaria). In concomitanza dei siti 33, 43 vi erano ancora presenti difetti angolari di 8 mm mesiale al 43 e di 12 mm mesiale al 33: entrambi difetti ossei composti a più pareti; in entrambi è stata eseguita prova di vitalità pulpare (positivo per entrambi) per escludere componenti endodontiche che causassero da sole o in sinergia il difetto angolare. Si è scelto quindi di migliorare la qualità dei tessuti parodontali intorno a questi denti così da poter effettuare in maniera semplice la gestione dei tessuti durante la chirurgia rigenerativa e poter alla fine della tecnica eseguire delle suture a materassaio verticale modificato (nodo di Laurell) così da stabilizzare i lembi e ottenere il massimo potenziale rigenerativo con la minor recessione tissutale.
Per ottenere questo miglioramento dei tessuti si è proceduto a pulire i siti con i difetti ossei attraverso un soft debridement sopra-sub-gengivale in modo da non ledere i tessuti e peggiorare la condizione iniziale dei tessuti (shrinkage tissutale) che avrebbe comportato un netto peggioramento dei tessuti in pre-chirurgia con conseguente aumento della recessione post intervento. La funzione coadiuvante del gel di XAN-CHX consente di migliorare la qualità dei tessuti agendo mediante l’azione chemiotattica della clorexidina ben conosciuta in odontoiatria.
Il paziente andrà a sostenere anche la terapia implantare per ripristinare la mancanza degli elementi 35, 26; per quanto riguarda zona 26 il sito si trova ad avere una quota di osso residua esigua e con un seno mascellare che si è pneumatizzato a causa della perdita prematura dei denti diatorici del 2 quadrante; per cui contestualmente all’inserimento dell’impianto osseo viene eseguita la tecnica di elevamento del seno mascellare per via laterale mediante l’apertura di una botola di idonee dimensioni e lo scollamento della membrana snaideriana con conseguente riempimento del volume creato con idrossiapatite in nanaoparticelle sintetica (fisiograft nano reinforced) e inserito contestualmente 1 impianto in titanio 4,0 x 13 mm (Ghimas Evo slim fit) con superficie ruvida in SLA.
Nel sito 35 è stato posizionato impianto in titanio 4,0 x 10 mm (Ghimas Evo slim fit) con una tecnica a lembo senza alcun incremento di osso ma gestendo i tessuti molli con l’ausilio di vite di guarigione dedicata.
Conclusioni
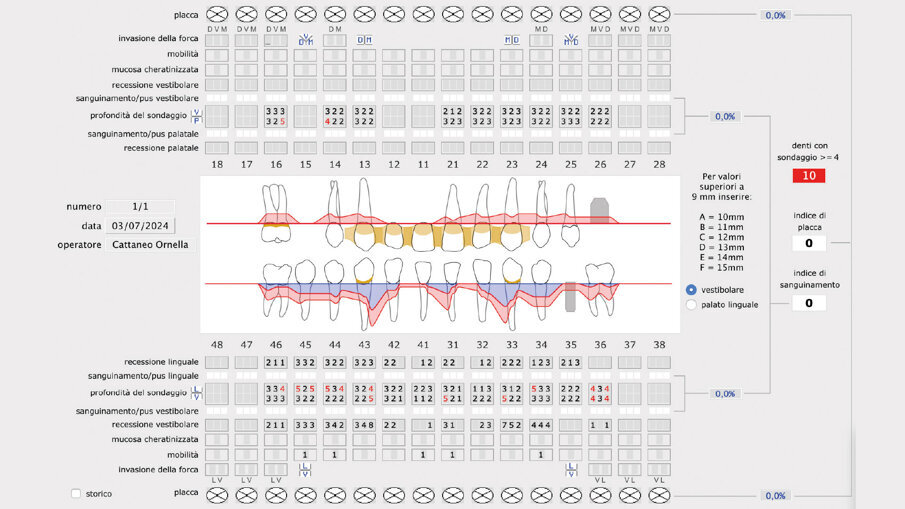
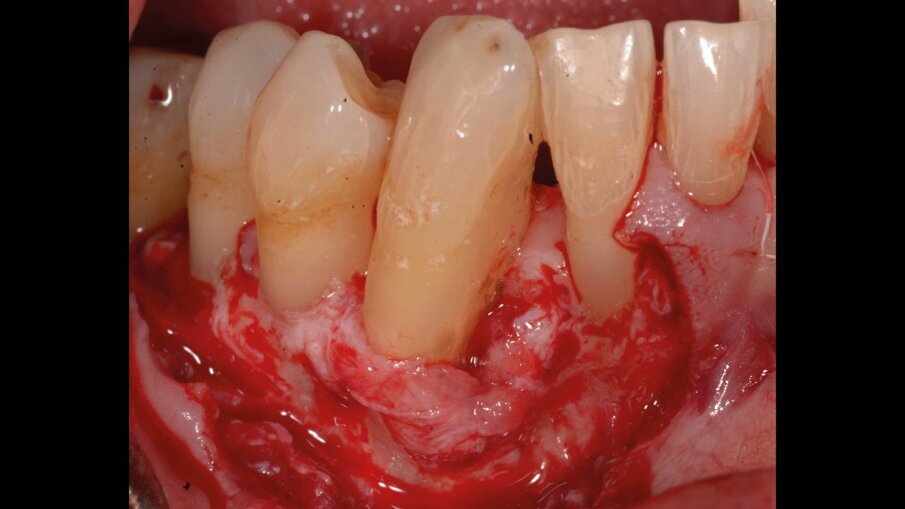
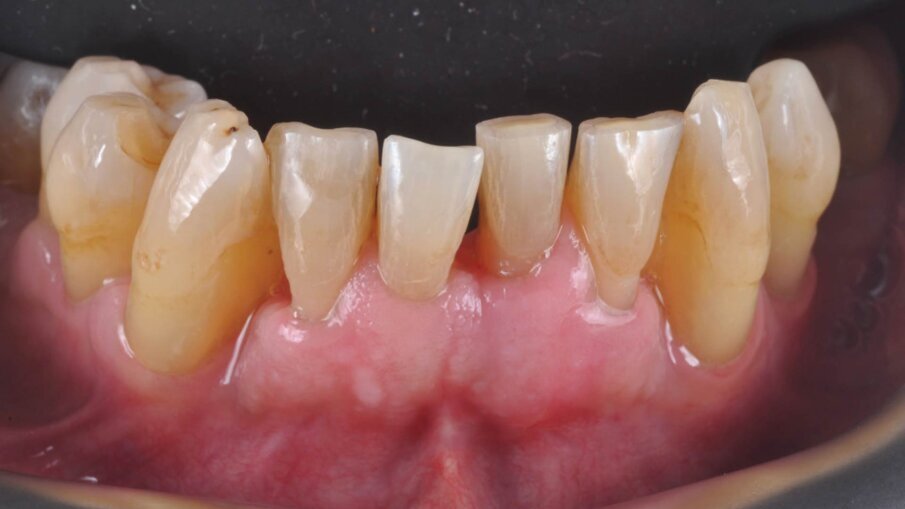
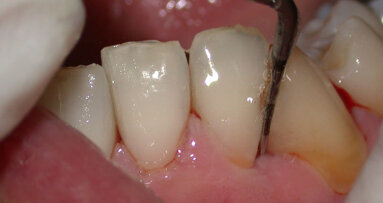
A fine terapia il paziente si presenta con i parametri biometrici nella norma, risulta sempre un paziente a rischio per cui viene istituita una terapia parodontale di supporto con periodicità di 4 mesi. A livello dei canini inferiori 33, 43 si è eseguita un GTR mediante chirurgia a lembo (single flap approach) a preservazione di papilla (modified papilla preservation technique); si è utilizzato, dopo aver eliminato il tessuto di granulazione nei difetti infraossei, l’edta (Prefgel) e le amelogenine (Emdogain) per amplificare il potere rigenerativo del sito parodontale (Figg. 8, 9).
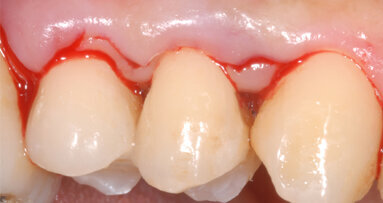
Il gel di XAN-CHX ha coadiuvato insieme alla terapia parodontale non chirurgica (1 livello) i siti individuati alla terapia GTR (guided tissue rigeneration) consentendo di ottenere un tessuto parodontale migliore in modo da consentire tutte le varie procedure chirurgiche di elevamento del lembo e successiva chiusura mediante sutura tali da rendere il tutto semplice senza complicazioni, normalmente causate da tessuti flaccidi e infiammati. Possiamo quindi evidenziare che utilizzando il gel di XAN-CHX sia possibile avere una migliore predicibilità nei trattamenti di chirurgia parodontale12-15, 22, 23-30, 31-33 (Figg. 10a-10c).
Bibliografia
- Sanz M, Quirynen M. European Workshop in Periodontology Group A. Advances in the aetiology of perio- dontitis. Group A: consensus report of the 5th European Workshop in Periodontology. J Clin Periodontol. 2005;32(Suppl 6):54-6. Doi: 10.1111/j.1600-051X.2005.00827.x.
- Tonetti MS, Jepsen S, Jin L, Otomo-Corgel J. Impact of the global burden of periodontal diseases on health, nutrition and wellbeing of mankind: A call for global action. J Clin Periodontol. 2017;44(5):456-462. Doi: 10.1111/jcpe.12732.
- Aimetti M, Perotto S, Castiglione A, Mariani GM, Ferrarotti F, Romano F. Prevalence of periodontitis in an adult population from an urban area in North Italy: findings from a cross-sectional population-based epide- miological survey. J Clin Periodontol. 2015;42(7):622-31. Doi: 10.1111/jcpe.12420.
- Kassebaum NJ, Bernabe E, Dahiya M, Bhandari B, Murray CJ, Marcenes W. Global burden of severe pe- riodontitis in 1990-2010: A systematic review and meta-regression. J Dent Res. 2014;93(11):1045-53. Doi: 10.1177/0022034514 552491.
- Lancet Diabetes Endocrinol. 2018;6(12):954-965. Doi: 10.1016/S2213-8587(18)30038-X. FDI World Dental Federation. The Challenge of Oral Disease – A call for global action. 2015. The Oral Health Atlas. 2nd edition. Geneva.
- Genco RJ, Borgnakke WS. Risk factors for periodontal disease. Periodontol 2000. 2013;62(1):59-94. Doi: 10.1111/j.1600-0757.2012.00457.x.
- Linden GJ, Lyons A, Scannapieco FA. Periodontal systemic associations: review of the evidence. J Periodon- tol. 2013;84(4 Suppl):S8-S19. Doi: 10.1902/jop.2013.1340010.
- Tonetti MS, D’Aiuto F, Nibali L, Donald A, Storry C, Parkar M, Suvan J, Hingorani AD, Vallance P, Dean- field J. Treatment of periodontitis and endothelial function. N Engl J Med. 2007;356(9):911-20. Doi: 10.1056/ NEJMoa063186.
- D’Aiuto F, Gkranias N, Bhowruth D, Khan T, Orlandi M, Suvan J, Masi S, Tsakos G, Hurel S, Hingorani AD, Donos N, Deanfield JE; TASTE Group. Systemic effects of periodontitis treatment in patients with type 2 diabetes: a 12 month, single-centre, investigator-masked, randomised trial.
- Tonetti MS, Greenwell H, Kornman KS. Staging and grading of periodontitis: Framework and proposal of a new classification and case definition. J Clin Periodontol. 2018;45 Suppl 20:S149-S161. Doi: 10.1111/ jcpe.12945.
- Raspini M, Cavalcanti R, Clementini M, Crea A, Di Stefano M, Fratini A, Karaboue M, Lacasella GV, Landi L, Larussa R, Littarru C, Sforza NM, Cairo F. La Parodontite e gli Italiani (2016-2020): necessità di linee guida per implementare una terapia efficace. Dental Cadmos. 2021;89(5):346-356. Doi: 10.19256/d.cad- mos.05.2021.05.
- Jones CG. Chlorhexidine: is it still the gold standard? Periodontol 2000. 1997 Oct;15:55-62. doi:10.1111/j.1600-0757.1997.tb00105.x.
- Paolantonio M, D’Ercole S, Pilloni A, D’Archivio D, Lisanti L, Graziani F, Femminella B, Sammartino G, Perillo L, Tetè S, Perfetti G, Spoto G, Piccolomini R, Perinetti G. Clinical, microbiologic, and biochemical effects of subgingival administration of a Xanthan-based chlorhexidine gel in the treatment of periodontitis: a randomized multicenter trial. J Periodontol. 2009 Sep;80(9):147992. doi: 10.1902/jop.2009.090050.
- Mummolo S, Severino M, Campanella V, Barlattani A Jr, Quinzi V, Marchetti E. Chlorhexidine gel used as antiseptic in periodontal pockets. J Biol Regul Homeost Agents. 2019 May-Jun;33(3 Suppl. 1):83-88. DENTAL SUPPLEMENT.
- Gautam A, Manish K, Kumar R. Treatment of periodontal disease using xanthan based chlorhexidine gel.
- Zhao H, Hu J, Zhao L. Adjunctive subgingival application of Chlorhexidine gel in nonsurgical periodontal treatment for chronic periodontitis: a systematic review and meta-analysis. BMC Oral Health. 2020 Jan 31;20(1):34. doi: 10.1186/s12903-020-1021 0.
- Heitz-Mayfield LJA, Salvi GE. Peri-implant mucositis. J Clin Periodontol. 2018 Jun;45 Suppl 20:S237-S245. doi: 10.1111/jcpe.12953.
- Lee CT, Huang YW, Zhu L, Weltman R. Prevalences of peri-implantitis and peri-implant mucositis: systematic review and meta-analysis. J Dent. 2017 Jul;62:1-12. doi: 10.1016/j. jdent.2017.04.011. Epub 2017 May 3.
- Schwarz F, Derks J, Monje A, Wang HL. Peri-implantitis. J Periodontol. 2018 Jun;89 Suppl 1:S267-S290. doi: 10.1002/JPER.16-0350.
- Ramanauskaite A, Fretwurst T, Schwarz F. Efficacy of alternative or adjunctive measures to conventional non-surgical and surgical treatment of peri-implant mucositis and peri-implantitis: a systematic review and meta-analysis. Int J Implant Dent. 2021 Nov 15;7(1):112. doi: 10.1186/s40729-02100388-x.
- Herrera D, Berglundh T, Schwarz F, Chapple I, Jepsen S, Sculean A, Kebschull M, Papapanou PN, Tonetti MS, Sanz M; EFP workshop participants and methodological consultant. Prevention and treatment of peri-implant diseases-The EFP S3 level clinical practice guideline. J Clin Periodontol. 2023 Jun;50 Suppl 26:4-76. doi: 10.1111/jcpe.13823. Epub 2023 Jun 4.
- Herrera D, Berglundh T, Schwarz F, Chapple I, Jepsen S, Sculean A, Kebschull M, Papapanou PN, Tonetti MS, Sanz M; EFP workshop participants and methodological consultant. Prevention and treatment of peri-implant diseases-The EFP S3 level clinical practice guideline. J Clin Periodontol. 2023 Jun;50 Suppl 26:4-76. doi: 10.1111/jcpe.13823. Epub 2023 Jun 4.
- Berglundh T, Armitage G, Araujo MG, Avila-Ortiz G, Blanco J, Camargo PM, Chen S, Cochran D, Derks J, Figuero E, Hämmerle CHF, Heitz-Mayfield LJA, Huynh-Ba G, Iacono V, Koo KT, Lambert F, McCauley L, Quirynen M, Renvert S, Salvi GE, Schwarz F, Tarnow D, Tomasi C, WangHL, Zitzmann Peri-implant diseases and conditions: Consensus report of workgroup 4 of the 2017 World Workshop on the Classification of Periodontal and Peri-Implant Diseases and Conditions. J Clin Periodontol. 2018 Jun;45 Suppl 20:S286-S291. doi: 10.1111/ jcpe.12957.
- Monje A, Pons R, Insua A, Nart J, Wang HL, Schwarz F. Morphology and severity of peri-implantitis bone defects. Clin Implant Dent Relat Res. 2019 Aug;21(4):635-643. doi: 10.1111/cid.12791. Epub 2019 May 14.
- Iorio-Siciliano V, Blasi A, Stratul SI, Ramaglia L, Sculean A, Salvi GE, Rusu D. Anti-infective therapy of peri-implant mucositis with adjunctive delivery of a sodium hypochlorite gel: a 6-month randomized triple-blind controlled clinical trial. Clin Oral Investig. 2020 Jun;24(6):1971-1979. doi: 10.1007/ s00784-019-03060-2. Epub 2019 Aug 21.
- Santana SI, Silva PHF, Salvador SL, Casarin RCV, Furlaneto FAC, Messora MR. Adjuvant use of multispecies probiotic in the treatment of peri-implant mucositis: A randomized controlled trial. J Clin Periodontol. 2022 Aug;49(8):828-839. doi: 10.1111/jcpe.13663. Epub 2022 Jun 10.
- Lombardo G, Signoretto C, Corrocher G, Pardo A, Pighi J, Rovera A, Caccuri F, Nocini PF. A topical desiccant agent in association with ultrasonic debridement in the initial treatment of chronic periodontitis: a clinical and microbiological study. New Microbiol. 2015 Jul;38(3):393-407. Epub 2015 Jul 6.
- Sahrmann P, Bettschart C, Wiedemeier DB, Al-Majid A, Attin T, Schmidlin PR. Treatment of Peri-Implant Mucositis with Repeated Application of Chlorhexidine Chips or Gel during Supportive Therapy – A Randomized Clinical Trial. Dent J (Basel). 2019 Dec 11;7(4):115. doi: 10.3390/dj7040115.
- de Waal YCM, Winning L, Stavropoulos A, Polyzois I. Efficacy of chemical approaches for implant surface decontamination in conjunction with sub-marginal instrumentation, in the non-surgical treatment of peri-implantitis: A systematic review. J Clin Periodontol. 2023 Jun;50 Suppl 26:212-223. doi: 10.1111/jcpe.13749. Epub 2022 Nov 25.
- Liñares A, Sanz-Sánchez I, Dopico J, Molina A, Blanco J, Montero E. Efficacy of adjunctive measures in the non-surgical treatment of peri-implantitis: A systematic review. J Clin Periodontol. 2023 Jun;50 Suppl 26:224-243. doi: 10.1111/jcpe.13821. Epub 2023 May 4.
- Gautam A, Manish K, Kumar R. Treatment of periodontal disease using xanthan based chlorhexidine gel. Bioinformation. 2021 Feb 28;17(2):326-330. doi: 10.6026/97320630017326.
- Laleman I, Pauwels M, Quirynen M, Teughels W. The usage of a lactobacilli probiotic in the non-surgical therapy of peri-implantitis: A randomized pilot study. Clin Oral Implants Res. 2020 Jan;31(1):84-92. doi: 10.1111/clr.13555. Epub 2019 Nov 25.
- Amodeo AA, Butera A, Lattari M, Stablum G, Abbinante A, Agneta MT, Lanzetti J, Tomassi D, Piscicelli S, Luperini M, Colavito A, Chiavistelli L, Politangeli R, Castaldi M, Nardi GM. Consensus Report of the Technical-Scientific Associations of Italian Dental Hygienists and the Academy of Advanced Technologies in Oral Hygiene Sciences on the Non-Surgical Treatment of Peri-Implant Disease. Int J Environ Res Public Health. 2023 Jan 27;20(3):2268. doi: 10.3390/ijerph20032268.
Tag:
Il controllo meccanico del biofilm è considerato lo standard di cura per le patologie peri-implantari. L’applicazione aggiuntiva di antisettici locali ...
Introduzione
La parodontite è una malattia infettiva caratterizzata dalla perdita di strutture di supporto del dente quali il tessuto connettivo e ...
Dopo la prima visita si propone al paziente un protocollo di trattamento. Come lo schema illustra (Fig. 1), previa diagnosi, se si decide di passare subito ...
Dopo la prima visita si propone al paziente un protocollo di trattamento. Come lo schema illustra (Fig. 1), previa diagnosi, se si decide di passare subito ...
La strumentazione parodontale non chirurgica è necessaria come trattamento iniziale, e come terapia di mantenimento, di qualsiasi patologia ...
La strumentazione non chirurgica rappresenta la prima fase terapeutica, essenziale e imprescindibile, dopo una diagnosi di patologia parodontale ...
Barcellona. Ricercatori spagnoli hanno trovato un’ulteriore prova della connessione fra parodontite e diabete di Tipo 2. In un recente studio hanno ...
Sono un’igienista dentale e lavoro nell’ambito della prevenzione orale fin dagli anni ‘80. Mi occupo anche di formazione e organizzo corsi rivolti ai ...
BRISTOL (GB). Un’unità dell’università di Bristol ha ricevuto 1 milione di sterline per aver introdotto sul mercato una nuova ...
La stabilizzazione del coagulo adeso alla superficie radicolare, in un ambiente protetto da interferenze di natura meccanica e microbiologica, è ...
Live webinar
ven. 12 dicembre 2025
19:00 (CET) Rome
Live webinar
ven. 12 dicembre 2025
20:00 (CET) Rome
Deepak Simkhada RDHT, BSc, MSc, PGCE, FSET, Cat Edney
Live webinar
lun. 15 dicembre 2025
11:30 (CET) Rome
Live webinar
lun. 15 dicembre 2025
20:00 (CET) Rome
Dr. Andrew Ip, Przemek Seweryniak
Live webinar
lun. 15 dicembre 2025
23:00 (CET) Rome
Live webinar
mer. 17 dicembre 2025
12:00 (CET) Rome
Dr. Piet Haers Oral and Maxillofacial Surgeon
Live webinar
mer. 17 dicembre 2025
22:00 (CET) Rome
Dr. Melissa Vettraino Bachstein DDS



 Austria / Österreich
Austria / Österreich
 Bosnia ed Erzegovina / Босна и Херцеговина
Bosnia ed Erzegovina / Босна и Херцеговина
 Bulgaria / България
Bulgaria / България
 Croazia / Hrvatska
Croazia / Hrvatska
 Repubblica Ceca e Slovacchia / Česká republika & Slovensko
Repubblica Ceca e Slovacchia / Česká republika & Slovensko
 Francia / France
Francia / France
 Germania / Deutschland
Germania / Deutschland
 Grecia / ΕΛΛΑΔΑ
Grecia / ΕΛΛΑΔΑ
 Ungheria / Hungary
Ungheria / Hungary
 Italia / Italia
Italia / Italia
 Paesi Bassi / Nederland
Paesi Bassi / Nederland
 nordisch / Nordic
nordisch / Nordic
 Polonia / Polska
Polonia / Polska
 Portogallo / Portugal
Portogallo / Portugal
 Romania e Moldavia / România & Moldova
Romania e Moldavia / România & Moldova
 Slovenia / Slovenija
Slovenia / Slovenija
 Serbia e Montenegro / Србија и Црна Гора
Serbia e Montenegro / Србија и Црна Гора
 Spagna / España
Spagna / España
 Svizzera / Schweiz
Svizzera / Schweiz
 Turchia / Türkiye
Turchia / Türkiye
 Gran Bretagna e Irlanda / UK & Ireland
Gran Bretagna e Irlanda / UK & Ireland
 Internazionale / International
Internazionale / International
 Brasile / Brasil
Brasile / Brasil
 Canada / Canada
Canada / Canada
 America Latina / Latinoamérica
America Latina / Latinoamérica
 USA / USA
USA / USA
 Cina / 中国
Cina / 中国
 India / भारत गणराज्य
India / भारत गणराज्य
 Pakistan / Pākistān
Pakistan / Pākistān
 Vietnam / Việt Nam
Vietnam / Việt Nam
 ASEAN / ASEAN
ASEAN / ASEAN
 Israel / מְדִינַת יִשְׂרָאֵל
Israel / מְדִינַת יִשְׂרָאֵל
 Algeria, Marocco e Tunisia / الجزائر والمغرب وتونس
Algeria, Marocco e Tunisia / الجزائر والمغرب وتونس
 Medio Oriente / Middle East
Medio Oriente / Middle East






















































To post a reply please login or register