L’intervento di elevazione del pavimento del seno mascellare è considerato una procedura chirurgica comune per l’inserimento degli impianti nell’osso mascellare posteriore severamente riassorbito in seguito a perdita di denti, riassorbimento osseo causato da parodontite, pneumatizzazione del seno mascellare, o una combinazione di queste cause.
La tecnica, presentata per la prima volta da Tatum1 nel 1977 e pubblicata per la prima volta da Boyne e James2 nel 1980, ha subito successivamente delle evoluzioni e modifiche legate sia alla strumentazione per eseguire l’intervento, sia ai materiali utilizzati per l’innesto. Sebbene l’osso autologo sia considerato il “gold standard” dei materiali da innesto, per le sue proprietà osteogeniche, osteoinduttive e osteoconduttive, i suoi maggiori svantaggi consistono nella necessità di avere un sito donatore, con annessa morbilità e dolore post-operatorio, la limitata disponibilità e un rapido riassorbimento. Gli innesti omologhi ed eterologhi possiedono buone capacità osteoconduttive. Tuttavia, a causa della loro origine umana o animale, il paziente potrebbe sollevare obiezioni al loro utilizzo per i rischi legati a un’infezione crociata o per motivazioni religiose. Per questo motivo i materiali alloplastici vengono sempre più utilizzati dai ricercatori per sviluppare un sostituto osseo (SO) sintetico efficace.
Le bioceramiche formate da fosfato di calcio, come l’idrossiapatite (HA) o il ß fosfato tricalcico (ß-TCP) sono dei SO biocompatibili, non immunogenici, osteoconduttivi ampiamente utilizzati. Tuttavia, sono sinterizzati a temperature comprese tra i 1.100 i 1.500 °C, e questa procedura aumenta la densità del materiale e ne diminuisce la porosità. Questi fattori possono influenzare il comportamento clinico di questi SO riducendone l’osteoconduttività e la biodegradabilità, portando a un tempo di riassorbimento molto lungo, a processi di infiammazione cronica e a una reazione da corpo estraneo3. Un nuovo tipo di bioceramica non sinterizzata – NanoBone® (NB, Artoss, Rostock, Germania), composta per il 76% da idrossiapatite nanocristallina, inglobata da una matrice composta da gel di silicio (24%) – viene prodotta con un procedimento sol-gel a 700 °C depositando nanocristalli di HA in una struttura di biossido di silicio, sviluppando una nanostruttura altamente porosa con una superficie interna di circa 84 m2/g.
La matrice di silicio viene rapidamente degradata e sostituita da componenti organici del paziente, come mucopolisaccaridi e glicoproteine con risapute funzioni di attrazione, adesione e differenziazione di cellule ossee come osteoblasti e osteoclasti, già al 12° giorno dopo l’innesto3.
La sostituzione dell’originale matrice in gel di biossido di silicio con molecole che formano una matrice organica, sembra essere l’evento chiave che causa la fase iniziale di degradazione dal biomateriale attraverso gli osteoclasti e la rapida produzione di nuovo osso4.
Caso clinico
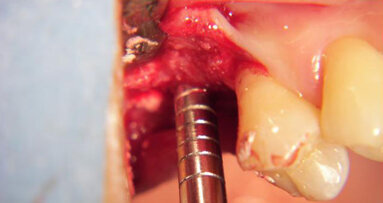
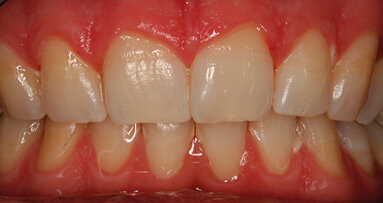
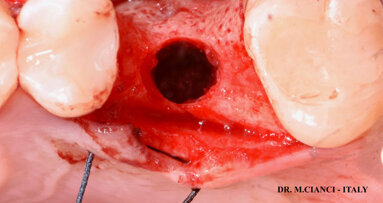
Viene riportato un caso clinico in cui, per la scarsa disponibilità di osso in altezza (Fig. 1), è stato effettuato un intervento di sollevamento della membrana del seno mascellare per via laterale (Fig. 2). La corticale ossea vestibolare è stata assottigliata con un raschietto per osso (Safescraper, Meta) nella porzione destinata all’apertura della botola, che è stata disegnata con una fresa a pallina diamantata (Fig. 3). Terminata l’osteotomia, la membrana è stata delicatamente sollevata con strumenti manuali fino ad arrivare alla parete mediale. I granuli di NanoBone® (Fig. 4), miscelati all’osso autologo corticale prelevato con raschietto in proporzione 5:1, sono stati inseriti all’interno del seno (Fig. 5). Una membrana in collagene (Cytoplast RTM, Osteogenics Biomedical, Lubbock, TX, Usa) è stata applicata a copertura dell’antrostomia. La TC Cone Beam post-operatoria ha mostrato il volume osseo rigenerato (Figg. 6 e 7). Dopo un periodo di guarigione di 13 mesi, dovuto a problemi lavorativi del paziente, il sito è stato riaperto per l’inserimento implantare (Fig. 8).
Con una fresa carotatrice (Fig. 9) è stato prelevato un campione di materiale innestato per la valutazione istologica (Fig. 10). Sono stati inseriti tre impianti Straumann Tissue Level (Fig. 11). Dopo un periodo di guarigione di 3 mesi il paziente è stato riabilitato con tre corone in metalloceramica (Figg. 13 e 14).
Valutazione istologica
La carota ossea è stata immediatamente fissata in formalina neutra tamponata al 10% e conservata a temperatura ambiente. Il campione è stato poi decalcificato in acido formico, disidratato in concentrazioni ascendenti di etanolo, e infine incluso in paraffina. Sezioni di 5-6 µm di spessore sono state tagliate con un microtomo (Leica, Solms, Germania) e colorate con ematossilina ed eosina (EE) e con la tricromica Azan-Mallory (AM). La valutazione istologica e la documentazione fotografica sono state effettuate con il microscopio Axiophot (Zeiss, Göttingen, Germany) a 12,5, 25, 100, 200, e 400 ingrandimenti.
L’analisi istologica ha rivelato una neoformazione ossea in tutte le parti del campione (Fig. 16), con una presenza omogenea di strutture ossee trabecolari in intimo contatto con la superficie dei granuli di NB, e spazi midollari con tessuto connettivo altamente vascolarizzato (Fig. 17). Non è stata osservata alcuna evidenza di infiammazione né una reazione da corpo estraneo attorno ai residui di NB, che erano parzialmente o totalmente inclusi da nuovo osso formatosi attorno.
La struttura ossea era prevalentemente di tipo lamellare, un osso maturo con i sistemi haversiani, le linee cementizie e gli osteociti, a sottolineare la vitalità del tessuto osseo (Fig. 18). I granuli di NB non degradati apparivano strutturalmente porosi e inomogenei, ed erano parzialmente circondati da tessuto osteoide o da osso immaturo a fibre intrecciate e contornati da strati di osteoblasti.
È stato possibile osservare infiltrazioni ed estensioni di tessuto osteoide all’interno della nanostruttura del granulo (Fig. 19).
embedImagecenter("Imagecenter_2_729",729,"small");
Discussione
La struttura fisicochimica dei biomateriali può compromettere il loro comportamento biologico e i risultati clinici. Sebbene l’uso di osso autologo venga ancora considerato come il gold standard dei materiali da innesto, il suo utilizzo viene limitato dalla disponibilità di un sito donatore adeguato e dalla morbilità ad esso associata. Gli innesti omologhi ed eterologhi sono considerati validi SO per le loro proprietà osteoconduttive. Tuttavia, per rimuovere le proteine immunogeniche, questi materiali vengono processati con tecniche di irradiazione o liofilizzazione, che ne diminuiscono le qualità rigenerative5.
La maggior parte dei SO alloplastici sono materiali a base di fosfato di calcio. Molti dei ß-TCP o delle HA sintetiche vengono sinterizzati durante la fase produttiva, risultando in materiali meno porosi e più compatti, con una superficie specifica inferiore ai 2 m2/g, e un’inferiore osteoconduttività6,7. Caratteristiche quali una bassa solubilità, una ridotta biodegradabilità e mancanza di fagocitabilità, influenzano negativamente la neoformazione ossea, che può venir disturbata, ritardata o esser mancante, e possono favorire l’infiammazione cronica7 o il sequestro8. Al contrario, il biomateriale qui utilizzato è una ceramica altamente porosa non sinterizzata prodotta con la tecnica sol-gel, dove i nanocristalli di HA si aggregano con le molecole di biossido di silicio, nel processo di transizione da sol in gel, formando un SO con struttura nanoporosa, caratterizzato da tre tipi di pori interconnessi7. I macropori (100 µm-1 mm) consentono l’invasione di tessuto vascolare per un corretto supporto sanguigno di elementi cellulari e fibrillari già dalle fasi iniziali. I micropori (5-100 µm) permettono la crescita al loro interno di osteoblasti e fibre di tessuto connettivo per una formazione ossea multicentrica all’interno delle particelle. I nanopori (2-10 nm) favoriscono l’entrata del siero e del plasma, e la successiva biodegradazione. L’ampia superficie interna (84 m2/g) è dovuta alla matrice di silicio che viene degradata e sostituita da una matrice organica, che contiene trombociti, fibrinogeno, fattori del complemento, e glicoproteine. La degradazione del gel di SiO2 espone le particelle di HA alle cellule osteogeniche e angiogenetiche che migrano all’interno del difetto osseo.
Il biossido di silicio stimola la formazione di collagene e osso, stimolando la proliferazione osteoblastica5. Angiogenesi e osteogenesi sono strettamente legate9.
Il supporto sanguigno è un fattore cruciale quando si usano i SO dal momento che una non corretta vascolarizzazione può ostacolare l’osteogenesi a causa di una ridotta conduzione dei nutrienti. Quindi, un’adeguata vascolarizzazione è di vitale importanza per la colonizzazione cellulare e l’osteogenesi per apposizione8.
L’angiogenesi è coinvolta nel successo della guarigione e dell’osteogenesi, perché i vasi sanguigni di nuova formazione, che originano dai preesistenti vasi attorno al difetto, entrano all’interno delle porosità dei granuli di NB per creare una rete inter-granulare che trasporta i precursori degli osteoblasti all’interno dei granuli10. La densità dei vasi e il numero degli osteoclasti all’interno dell’area rigenerata sono stati riscontrati essere significativamente superiori rispetto all’osso maturo residuo5.
La biodegradazione del materiale avviene con la stessa velocità con cui viene a formarsi il nuovo osso7 e sembra coinvolgere un riassorbimento cellulare piuttosto che una degradazione enzimatica5, attraverso cellule mononucleari di riassorbimento (macrofagi e istiociti) nelle fasi iniziali8 e cellule multinucleate come i macrofagi e i loro precursori11.
Le particelle di NB vengono incorporate dall’organismo e inserite nel processo di rimodellamento, essendo riassorbite dagli osteoclasti, senza alcun segno di infiammazione.
In uno studio animale il riassorbimento da parte degli osteoclasti è stato osservato in tutte le fasi temporali, evidenziando una continua ma non eccessiva degradazione del NB12. Una degradazione più veloce potrebbe influenzare negativamente il potenziale rigenerativo del materiale. In uno studio in vivo, la valutazione istologica di siti trattati con granuli di ß-TCP non ha rilevato alcun residuo del SO. Tuttavia, attorno all’osso neoformato vi era tessuto connettivo con infiammazione cronica.
L’osservazione, attorno alla stessa particella di NB, di un lato con osteoclasti e un altro lato con osteoblasti dimostra l’integrazione del biomateriale nel processo di rimodellamento dell’organismo umano10.
In uno studio clinico di innesto nel seno mascellare, solamente circa il 50% delle particelle inizialmente innestate erano ancora presenti dopo 3 mesi8. A questo materiale è stato inoltre attribuito un potenziale osteoinduttivo10, ovvero la capacità di stimolare e supportare la proliferazione e il differenziamento osteogenico delle cellule progenitrici mesenchimali dell’organismo ospite.
L’innesto di NB in tessuto ectopico, come il tessuto adiposo sottocutaneo, o il muscolo di pecore e maialini, ha indotto la formazione di strutture ossee anche solo dopo 5 settimane4,12. Questo fattore sembra essere causato dalla nanostruttura del biomateriale poroso, mentre la sostituzione della matrice di silicio con una matrice organica che incorpora proteine e fattori di crescita è considerata come l’evento chiave che inizia questo processo. L’immunoistochimica, eseguita su biopsie umane, ha consentito di marcare le molecole coinvolte nel differenziamento osteoblastico, nella mineralizzazione e nel rimodellamento osseo10. Una forte colorazione immunoistochimica è stata ottenuta per l’osteocalcina, l’osteopontina all’interno e attorno ai granuli, la presenza di BMP-2 nella matrice di NB, la fosfatasi alcalina, il collagene di tipo 1, strutture vasali positive al fattore di Von Villebrand4. Il più importante fattore angiogenetico, il fattore di crescita vascolare endoteliale (VEGF), è stato osservato in campioni umani prelevati da siti rigenerati con NB10. Anche altri fattori angiogenetici sono stati riscontrati, quali l’osteopontina e i fattori indotti dall’ipossia, ovvero fattori di trascrizione attivati da uno stato catabolico o ipossico9.
L’indagine immunoistochimica con l’utilizzo di anticorpi ED I, un marcatore di cellule della linea fagocitaria mononucleare, ha mostrato la presenza di macrofagi e precursori osteoclastici attorno ai granuli del materiale. Le cellule osteoclastiche non erano localizzate solamente sulla superficie del tessuto osseo neoformato ma anche sui granuli di NB10. La marcatura di cellule con run x2 nel tessuto connettivo, specialmente attorno ai vasi, ha dimostrato che i precursori degli osteoblasti possono originare dalle aree perivascolari del tessuto connettivo, sostenendo quindi il potenziale osteoinduttivo del materiale10.
L’utilizzo di questo materiale è stato ben documentato per la procedura di aumento del seno mascellare con risultati eccellenti sia posizionando gli impianti contestualmente13, con un carico già dopo 3 mesi di guarigione14, sia con l’approccio in due fasi che ha permesso anche la valutazione istologica e immunoistochimica5,11,15,16. Paragonata ad altri SO, è stata osservata un’accelerata formazione di nuovo osso che, già dopo 3 mesi aveva portato ad un volume osseo idoneo alla stabilizzazione degli impianti8. Nel caso sopra riportato il tempo di attesa tra l’aumento osseo e l’inserimento implantare è stato involontariamente di 13 mesi, contro i 6 programmati, per questioni legate al lavoro del paziente, che lo hanno tenuto lontano da casa per diversi mesi. Questo fatto, però, ha fornito la possibilità di valutare come si comporta un innesto di NB in un periodo di tempo assai più lungo di quello che normalmente è ritenuto sufficiente per avere una formazione ossea adeguata alla stabilizzazione degli impianti. La qualità ossea osservata a 13 mesi, osso maturo di tipo lamellare, è ben diversa dal tessuto osteoide o dall’osso immaturo a fibre intrecciate riscontrate a distanza di 3 mesi. Sebbene il riassorbimento di NB sia stato dimostrato essere pressoché totale (93%) nel maialino a distanza di 8 mesi7, è bene risaputo che il modello animale differisce dall’uomo per il differente metabolismo. In più, i difetti sperimentali creati erano più piccoli rispetto alla grandezza del seno mascellare.
Questo per spiegare che le cellule impiegano più tempo per migrare dalle pareti ossee circostanti nel difetto in un seno mascellare piuttosto che in un difetto di pochi mm. Più l’ospite è giovane, maggiore è il numero di cellule mesenchimali indifferenziate presenti, e normalmente gli animali da esperimento sono giovani, mentre i nostri pazienti sono adulti o anziani. Per tutto ciò, i valori di tempo riscontrati nel modello animale non corrispondono a quelli riscontrati nell’uomo. Il sostituto osseo a 13 mesi non era completamente riassorbito; tuttavia, i segni della sua degradazione erano testimoniati dalla presenza di nuovo osso all’interno dei granuli (Figg. 17 e 18) e dalle infiltrazioni di tessuto osteoide nelle nanoporosità del materiale (Fig. 19), cosa che normalmente non si riscontra per gli altri materiali, che invece hanno una formazione ossea apposizionale solo lungo la loro superficie esterna.
L’utilizzo della membrana in collagene a protezione dell’antrostomia è stata applicata per escludere il tessuto connettivo non osteogenico dal sito innestato e avere una maggiore neoformazione ossea e una percentuale maggiore di sopravvivenza implantare, come dimostrato in letteratura17. La biocompatibilità di NB è stata testata in vitro, dimostrando bassa citotossicità e buona biocompatibilità, supportando la proliferazione osteoblastica meglio del sostituto osseo bovino18. Questa e altre caratteristiche sono richieste dall’ingegneria tissutale e dai ricercatori che si occupano di biomateriali per lo sviluppo di un SO che non si comporti solo da riempitivo o da scaffold, ma che guidi anche la rigenerazione ossea con la totale sostituzione da parte dell’ospite dopo un determinato periodo di tempo.
Ringraziamenti
L’autore desidera ringraziare il sig. Ezio Bassotti dell’Istituto di Clinica odontoiatrica dell’Università Cattolica - Policlinico Universitario “A. Gemelli” di Roma per la realizzazione dei preparati istologici.
Bibliografia
1. Tatum OH. Maxillary sinus grafting for endosseous implants. Presented at the Annual Meeting of the Alabama Implant Study Group. Birmingham, Alabama, April 1977.
2. Boyne PJ, James RA. Grafting of the maxillary sinus floor with autogenous marrow and bone. J Oral Surg 1980;38:613-616.
3. Punke C, Zehlicke T, Just T, Holzhϋter, Gerber T, Pau HW. Matrix change of bone grafting substitute after implantation into guinea pig bulla. Folia Morphol (Warsz) 2012;71:109-114.
4. Gerber T, Lenz S, Holzhüter, Götz, Helms K, Harms C, Mittlmeier T. Nanostructured bone grafting substitutes – A pathway to osteoinductivity. Key Engineering materials 2012;493-494:147-152.
5. Ghanaati S, Brbeck M, Willerhausen I, Thimm B, Stuebinger S, Korzinskas T, Obreja K, Landes C, Kirkpatrick CJ, Sader RA. Nanocrystalline hydroxyapatite bone substitute leads to sufficient bone tissue formation already after 3 months: histological and hystomorphometrical analysis 3 and 6 months following human sinus cavity augmentation. Clin Implant Dent Relat Res 2012 Jan 17:1-10.
6. Gerike W, Bienengraber V, Henkel KO, Bayerlein T, Proff P, Gedrange T, Gerber T. The manufacture of synthetic non sintered and degradable bone grafting substitutes. Folia Morphology (Warsz) 2006;65:54-55.
7. Henkel KO, Gerber T, Lenz S, Gundlach KKH, Bienengräber V. Macroscopical, histological, and morphometric studies of porous bone-replacement materials in minipigs 8 months after implantation. Oral Surg Oral Med Oral Pathol Oral Radiol Oral Endod 2006;102:603-613.
8. Mejer J, Wolf E, Bienengräber V. Application of the synthetic nanostructured bone grafting material NanoBone® in sinus floor elevation. Implantologie 2008;16(3):301-31.
9. Götz W, Reichert C, Canullo L, Jäger A, Heineman F. Coupling of osteogenesis and angiogenesis in bone substitute healing – A brief overview. Annals of Anatomy 2012;194:171-173.
10. Götz W, Gerber T, Michel B, Lossdörfer S, Henkel KO, Heinemann F. Immunohistochemical characterization of nanocrystalline hydroxyapatite silica gel (Nanobone®) osteogenesis: a study on biopsies from human jaws. Clin Oral Impl Res 2008;19:1016-1026.
11. Stuebinger S, Ghanaati S, Orth C, Hilbig U, Saldamli B, Biesterfeld S, Kirkpatrick CJ, Sader RA. Maxillary sinus grafting with a nano-structured biomaterial: preliminary clinical and histological results. Eur Surg Res 2009;42:143-149.
12. Götz W, Lenz S, Reichert C, Henkel KO, Bienengräber V, Gundlach KKH, Gredes T, Gerber T, Gedrange T, Heinemann F. A preliminary study in osteoinduction by a nanocrystalline hydroxyapatite in the mini pig. Folia Histochemica et Cytobiologica 2010;48(4):589-596.
13. Heinemann F, Mundt T, Biffar R, Gedrange T, Goetz W. A 3-year clinical and radiographic study of implants placed simultaneously with maxillary sinus floor augmentations using a nanocrystalline hydroxyapatite. Journal of Physiology and Pharmacology 2009;60(Suppl 8):91-97.
14. Canullo L, Patacchia O, Sisti A, Heinemann F. Implant restoration 3 months after one stage sinus lift surgery in severely resorbed maxillae: 2-year results of a multicenter prospective clinical study. Clin Implant Dent Relat Res 2012;14:412-20.
15. Canullo L, Dellavia C. Sinus lift using a nanocrystalline hydroxyapatite silica gel in severely resobed maxillae: histological preliminary study. Clin Implant Dent Relat Res Oct; 11 Suppl 1:e7-13. Epub 2009 Feb 1.
16. Canullo L, Dellavia C, Heinemann F. Maxillary sinus floor augmentation using a nano-crystalline hydroxyapatite silica gel: case series and 3-month preliminary histological results. Annals of Anatomy 2012;194:174-178.
17. Tarnow DP, Wallace SS, Froum SJ. Histologic and clinical comparison of bilateral sinus floor elevations with and without barrier membrane placement in 12 patients: Part 3 of an ongoing prospective study. Int J Periodontics Restorative Dent 2000;20:116-125.
18. Liu Q, Douglas T, Zamponi C, Becker ST, Sherry E, Sivananthan S, Warnke F, Wiltfang J, Warnke PH. Comparison of in vitro biocompatibility of NanoBone® and Bio-Oss® for human osteoblasts. Clin Oral Impl Res 2011;22:1259-64.
L'articolo è stato pubblicato sul numero 1 di Implant Tribune 2013 Italy
Una recente revisione sistematica pubblicata su BMC Oral Health ha esaminato l’efficacia clinica dell’ozonoterapia nelle principali aree ...
Le più attuali tendenze dell’implantologia orale sono tese alla riduzione dei tempi di trattamento. Questa tendenza si scontra spesso con ...
La parte più esposta del nostro corpo è il viso, parla e comunica per noi ancora prima che si inizi un dialogo: il sorriso è forse il ...
La parte più esposta del nostro corpo è il viso, parla e comunica per noi ancora prima che si inizi un dialogo: il sorriso è forse il ...
SILVER SPRING - La Food and Drug Administration aggiorna le raccomandazioni circa l'uso di sostituti per innesto osseo contenenti proteine ricombinanti o ...
Test di laboratorio Colgate mostrano che dentifricio e collutorio neutralizzano il 99,9% del virus che causa il COVID-19.
Il programma di ricerca clinica ...
Il sorriso ideale è da sempre considerato espressione di salute e bellezza1,2. Fu la civiltà romana a consacrare la tradizione del dente ...
Il sorriso ideale è da sempre considerato espressione di salute e bellezza1,2. Fu la civiltà romana a consacrare la tradizione del dente ...
In presenza di gravi atrofie ossee, spesso conseguenza di estrazioni effettuate in giovane età, la riabilitazione implanto-protesica può andare incontro a...
Negli ultimi 10 anni l’utilizzo di impianti corti per riabilitazioni implanto-protesiche nei mascellari atrofici è aumentato notevolmente: in letteratura...
Live webinar
lun. 9 marzo 2026
17:30 (CET) Rome
Live webinar
lun. 9 marzo 2026
20:00 (CET) Rome
Live webinar
mar. 10 marzo 2026
9:00 (CET) Rome
Assoc. Prof. Aaron Davis, Prof. Sarah Baker
Live webinar
mer. 11 marzo 2026
1:00 (CET) Rome
Dr. Vasiliki Maseli DDS, MS, EdM
Live webinar
mer. 11 marzo 2026
17:00 (CET) Rome
MDT Andreas Chatzimpatzakis
Live webinar
gio. 12 marzo 2026
17:00 (CET) Rome
Live webinar
mar. 17 marzo 2026
13:00 (CET) Rome



 Austria / Österreich
Austria / Österreich
 Bosnia ed Erzegovina / Босна и Херцеговина
Bosnia ed Erzegovina / Босна и Херцеговина
 Bulgaria / България
Bulgaria / България
 Croazia / Hrvatska
Croazia / Hrvatska
 Repubblica Ceca e Slovacchia / Česká republika & Slovensko
Repubblica Ceca e Slovacchia / Česká republika & Slovensko
 Francia / France
Francia / France
 Germania / Deutschland
Germania / Deutschland
 Grecia / ΕΛΛΑΔΑ
Grecia / ΕΛΛΑΔΑ
 Ungheria / Hungary
Ungheria / Hungary
 Italia / Italia
Italia / Italia
 Paesi Bassi / Nederland
Paesi Bassi / Nederland
 nordisch / Nordic
nordisch / Nordic
 Polonia / Polska
Polonia / Polska
 Portogallo / Portugal
Portogallo / Portugal
 Romania e Moldavia / România & Moldova
Romania e Moldavia / România & Moldova
 Slovenia / Slovenija
Slovenia / Slovenija
 Serbia e Montenegro / Србија и Црна Гора
Serbia e Montenegro / Србија и Црна Гора
 Spagna / España
Spagna / España
 Svizzera / Schweiz
Svizzera / Schweiz
 Turchia / Türkiye
Turchia / Türkiye
 Gran Bretagna e Irlanda / UK & Ireland
Gran Bretagna e Irlanda / UK & Ireland
 Internazionale / International
Internazionale / International
 Brasile / Brasil
Brasile / Brasil
 Canada / Canada
Canada / Canada
 America Latina / Latinoamérica
America Latina / Latinoamérica
 USA / USA
USA / USA
 Cina / 中国
Cina / 中国
 India / भारत गणराज्य
India / भारत गणराज्य
 Pakistan / Pākistān
Pakistan / Pākistān
 Vietnam / Việt Nam
Vietnam / Việt Nam
 ASEAN / ASEAN
ASEAN / ASEAN
 Israel / מְדִינַת יִשְׂרָאֵל
Israel / מְדִינַת יִשְׂרָאֵל
 Algeria, Marocco e Tunisia / الجزائر والمغرب وتونس
Algeria, Marocco e Tunisia / الجزائر والمغرب وتونس
 Medio Oriente / Middle East
Medio Oriente / Middle East


















































To post a reply please login or register