Inquadramento clinico di una patologia cronica a eziologia sconosciuta, fortemente invalidante e di sempre maggior diffusione.
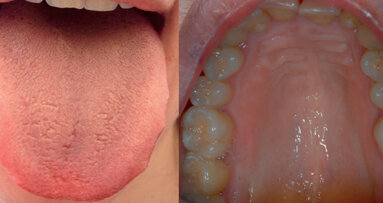
La Burning Mouth Syndrome (BMS) o sindrome della bocca urente, è una patologia cronica a eziologia sconosciuta, fortemente invalidante e di sempre maggiore diffusione nella nostra società. È conosciuta in letteratura anche con i termini di stomatodinia, orodinia, glossodinia, glossopirosi, stomatopirosi, disestesia orale. Il suo inquadramento nosologico è ancora oggi molto dibattuto e crea difficoltà nella corretta classificazione dei sintomi e soprattutto nella gestione terapeutica di questi pazienti1. La prevalenza stimata della malattia varia tra lo 0,7 e il 3,6% negli uomini e tra lo 0,6 e il 12,2% nelle donne (rapporto uomini-donne 1:7 o 1:3 a seconda degli studi esaminati); insorge più frequentemente nella quinta-settima decade di vita ed è rara al di sotto dei 30 anni2. L’International Association for the Study of Pain (IASP) la definisce come un’entità nosologica distinta, caratterizzata da una sintomatologia intraorale urente, accompagnata talvolta da secchezza e prurito, fino a vere e proprie algie, che persiste da almeno 4-6 mesi, con una mucosa orale clinicamente sana, in assenza di alterazioni patologiche locali o sistemiche3 (Figg. 1, 2). Il bruciore, localizzato a un distretto o diffuso a tutto il cavo orale, è il sintomo prevalente della malattia e coinvolge principalmente la lingua e le labbra, seguite in ordine di frequenza da: palato duro, creste alveolari guance e pavimento della bocca. L’intensità è notevole e influisce notevolmente sulla qualità di vita del paziente. Generalmente è meno accentuato al mattino, per intensificarsi nel prosieguo della giornata, si attenua durante il pasto, bevendo bibite fresche e durante lo svolgimento di attività ricreative o professionali4.
Spesso i pazienti riferiscono altri disturbi sensoriali superficiali (sensazione di corpo estraneo, sabbia sulle superfici dentarie, xerostomia, prurito e dolore puntorio), continua necessità di bere (polidipsia), sapore metallico, alterazioni fino alla perdita del gusto (disgeusia o ageusia), alterazioni dell’olfatto (disosmia) o, più raramente, perdita dell’olfatto (anosmia). Tali sensazioni non devono essere riconducibili ad alcuna patologia organica, per cui la diagnosi di BMS si ottiene per esclusione di tutte le altre possibili cause locali o sistemiche potenzialmente alla base della sintomatologia5.
In associazione alla sintomatologia orale sono spesso riferiti anche altri sintomi medici inspiegabili extradistrettuali (medically unexplained physical symptoms, MUSS), come bruciore in sede genitale (vulvodinia), anale (anodinia), disturbi nel distretto otorino (disfagia, faringodinia, odinofagia), disturbi gastrointestinali, oltre a sintomi corporei diffusi ma difficilmente inquadrabili6.
Le alterazioni sensoriali tipiche della BMS compaiono di solito dopo un evento stressante o debilitante (menopausa, lutto, malattia prolungata ecc.) per cui la storia psicosociale, insieme ai dati clinici, è cruciale ai fini della diagnosi. Spesso l’evento stressante riferito dal paziente è un intervento odontoiatrico traumatico o non gradito3. La BMS ha un decorso cronico, che può essere continuo o intermittente, e permane per un periodo di tempo variabile che può andare da pochi mesi a molti anni; è stato più volte riportato in letteratura che oltre la metà dei pazienti va incontro a remissione spontanea, completa o parziale, dopo circa 6-7 anni; successivamente la patologia poteva ripresentarsi con una sintomatologia simile o differente7.
L’eziopatogenesi di questa patologia ancora non è ben nota ed è considerata multifattoriale dal momento che coinvolge l’interazione di meccanismi neurofisiologici e fattori psicologi.
L’analisi psicologica del soggetto non va mai sottovalutata; diversi studi hanno dimostrato un’associazione con cancerofobia, ansia, depressione e disturbi del sonno, tuttavia è difficile determinare se le manifestazioni psichiatriche siano primarie o secondarie al disturbo, o se invece siano parte integrante della sindrome8.
Alcuni autori sostengono che i disturbi del tono dell’umore sono secondari perché la cronicità del dolore determina nel paziente un profondo mutamento dal punto di vista sia psicologico sia sociale. Inoltre, più a lungo il paziente soffre, maggiore diventa l’influenza dei fattori psicologici sulla propria esperienza di dolore. L’intensificazione psicologica generalmente procede finché la sofferenza è visibilmente sproporzionata rispetto all’input nocicettivo periferico9. Secondo altri autori i disturbi del tono dell’umore potrebbero precedere o insorgere simultaneamente alla BMS. Riguardo alla prevalenza di alterazioni depressive e ansiose, nella letteratura si riscontrano dati contrastanti. Alcuni autori considerano la depressione come il più comune disordine emotivo nei pazienti con BMS, ma anche l’ansia sembra svolgere un ruolo importante10. In uno studio recente, Schiavone e collaboratori hanno ipotizzato che l’ansia di tratto e di stato possa determinare una demoralizzazione secondaria in soggetti affetti da BMS e che i sintomi depressivi possano contribuire alla sintomatologia dolorosa (dolore funzione della depressione). Il dolore potrebbe dunque rappresentare una manifestazione somatica della depressione in soggetti con un tratto ansioso. Le caratteristiche ansiose, unite alla tendenza alla somatizzazione, potrebbero essere associate a una sintomatologia depressiva più o meno marcata (dalla demoralizzazione secondaria al disturbo depressivo maggiore); tale ipotesi è in accordo con la psicopatologia classica che descrive la stabilità del sintomo ansioso su quello depressivo (tendenza del soggetto ansioso a mantenere le caratteristiche del disturbo invariate nel tempo, con la possibilità di associazione con un disturbo depressivo, piuttosto che sviluppo di un disturbo d’ansia in un soggetto depresso non ansioso)11-12.
Inoltre, alcuni autori hanno evidenziato che sintomi differenti si associano a profili psicologici diversi; in particolare il sapore metallico e la sensazione di film sulle gengive erano associati in modo significativo con una maggiore punteggio nella scala della depressione; mentre la disgeusia, l’alitosi e l’ipocondria sono stati associati con i punteggi di ansia più elevati13. È stato inoltre evidenziato, da Liu, che pazienti affetti da BMS e depressione presentano un minore flusso sanguigno cerebrale nei lobi parietali e temporali di sinistra alla tomografia a emissione di fotoni singolo e calcolato (SPECT/CT)14.
Anche studi di genetica molecolare sembrano confermare la correlazione tra i disturbi del tono dell’umore e la BMS; Guimarães e altri hanno evidenziato che i pazienti affetti da BMS presentano polimorfismi genetici nella regione promotore del gene che codifica per il trasportatore della serotonina (5-HT) (SERT, SLC6A4) associato a un aumento della produzione di interleuchina 1-beta, una citochina proinfiammatoria associata alla modulazione del dolore15. Ciò potrebbe spiegare la risposta farmacologica dei pazienti affetti da BMS agli inibitori della ricaptazione della serotonina (SSRI). Alcuni autori ritengono che alla base della patologia ci sia una neuropatia periferica, altri ipotizzano una neuropatia centrale.
Lauria e collaboratori hanno recentemente dimostrato che i pazienti con BMS presentavano una neuropatia sensoriale delle piccole fibre del trigemino, localizzata ai due terzi anteriori della lingua, con perdita significativa di fibre nervose epiteliali e subpapillari. La diminuzione delle fibre nervose di piccolo calibro era associata, a sua volta, a una sovraespressione dei recettori TRPV1, per la capsaicina e del suo regolatore NGF (Nerve Growth Factor), la cui stimolazione è alla base della sensazioni dolorifiche; l’aumento dei recettori spiegherebbe l’iperalgesia tipica di questi pazienti16. Altri autori, invece ritengono che un ruolo eziologico nella BMS sia determinato da un’ipofunzione della corda del timpano e del glossofaringeo, che determinerebbero un aumento della sensibilità dolorifica associato ad alterazione del gusto17. Jääskeläinen, attraverso studi neurofisiologici e test quantitativi sensoriali basati su stimolazioni elettrofisiologiche, ha evidenziato nei pazienti affetti da BMS risultati anormali nel riflesso d’ammiccamento (blink reflex), alterazioni del sistema sensoriale tattile e alterazioni della conduzione del dolore per un’aumentata eccitazione del sistema trigeminale, dovuta alla disfunzione delle fibre mieliniche sensoriali del nervo stesso (A delta e C) o delle sue connessioni centrali all’interno del tronco encefalico18. Hagelberg et al., in uno studio sulla componente centrale della sindrome, hanno evidenziato come il sistema dopaminergico nigrostriatale sia coinvolto nella modulazione del dolore.
Tale studio, dimostra una disfunzione presinaptica di tale sistema nella BMS evidenziando un aumento della captazione del raclopride-C e una diminuzione del rapporto tra i recettori dopaminergici D1 e D2 nel putamen nei pazienti con BMS se paragonati al gruppo di controllo. L’aumentata capacità di legame del recettore D2 potrebbe indicare una diminuzione della dopamina endogena nel putamen, con risultati che sostengono dunque l’ipotesi di un’ipofunzione dopaminergica nigrostriatale nella patofisiologia della BMS. Tale ipoattività potrebbe quindi spiegare l’alterata modulazione del dolore in questi pazienti19. Albuquerque et al., in uno studio effettuato con risonanza magnetica funzionale dopo stimolazione termica del trigemino nei pazienti con BMS, hanno rilevato un pattern di attivazione cerebrale differente sia qualitativamente sia quantitativamente rispetto al controllo, evidenziando che una netta ipoattività cerebrale può avere un ruolo nella fisiopatologia della malattia. I risultati ottenuti indicano che i pazienti con BMS hanno subito un danneggiamento nella dinamica del network cerebrale, dando luogo a una diminuzione del controllo inibitorio sulle afferenze sensoriali; di conseguenza la propriocezione orale è avvertita come bruciore. È stata infatti riscontrata una diminuita funzionalità del pathway inibitorio discendente adrenergico e serotoninergico, che può essere causa o contribuire alla genesi, del dolore cronico. È probabile che un talamo ipofunzionante svolga un ruolo cruciale nella diminuzione del controllo inibitorio, come si verifica in altre condizioni di doloreneuropatico20. In un recentissimo studio, eseguito con metodiche di neuroimaging con la morfometria basata sui voxel (sigla VBM, dall’inglese voxel based morphometry), Sinding e collaboratori hanno analizzato la concentrazione di materia grigia dei pazienti con BMS e disgeusia, evidenziando una ridotta concentrazione di materia grigia nel giro cingolato anteriore, nel cervelletto, nel lobo temporale inferiore, nella corteccia dorsolaterale e prefrontale mediale, aree deputate al controllo del dolore nei pazienti con BMS. Pertanto, la riduzione della materia grigia in alcune aree cerebrali porta alla mancanza di controllo inibitorio del dolore21.
Tali studi confermano quelli effettuati precedentemente da Khan et al.22 e sono la base per lo studio di Umezaki, nel quale la stimolazione magnetica transcranica ripetitiva (rTMS) su corteccia prefrontale sinistra induce effetto analgesico sul dolore23.
L’iter diagnostico della BMS si esegue escludendo in primis i quadri di bruciore orale secondario a:
- fattori locali (BMSfl): lichen planus, alcune forme acute e croniche di candidosi, allergie da contatto, traumatismi cronici, parafunzioni, e traumatismi cronici;
- quadri patologici sistemici (BMSfg): Sindrome di Sjogren, stati carenziali, in particolare del complesso vitaminico B, diabete, squilibri ormonali, distiroidismo, anemia sideropenica, xerostomia da farmaci24.
Successivamente, si eseguono un esame clinico ed esami di laboratorio fondamentali per ricercare eventuali patologie organiche.
Gli esami da richiedere sistematicamente sono:
- un esame microbiologico colturale per la ricerca di infezioni micotiche e batteriche;
- emocromo con formula leucocitaria, glicemia, emoglobina glicosilata, azotemia, VES, sideremia, ferritina, indice di saturazione della transferrina, transaminasi, ricerca sierologica per anticorpi dell’epatite B e C, screening tiroideo, dosaggio della vitamina B12 e folati sierici;
- ricerca di immunoglobuline sieriche, ANA, ENA, frazioni del complemento C3 e C4;
- ecografia delle ghiandole salivari, qualora si sospettino disturbi della salivazione per patologie ghiandolari primitive;
- test allergologici cutanei (Patch Test), per eventuali intolleranze a materiali odontoiatrici;
- in presenza di sintomatologia specifica RMN o la TAC con il contrasto dell’encefalo e del tronco encefalico per escludere tumori intracranici;
- ricerca degli anticorpi anti-Helicobacter Pylori ed eventuale consulenza gastroenterologica, per escludere patologie del tratto gastroenterico;
- test per la valutazione dell’ansia, della depressione, dei disturbi del sonno e della personalità (HAM-A, HAM-D, STAY, PSQI, ESS) per una valutazione dello status psicologico del paziente.
L’assenza di dati anamnestici significativi, di lesioni morfologiche e strutturali delle mucose, di alterazioni ematochimiche e di positività nei valori degli esami di laboratorio e strumentali, nonché la persistenza della sintomatologia dopo il trattamento o la correzione delle condizioni locali e/o sistemiche predisponenti, depongono per la diagnosi di BMS su base neurologica. Tutte queste difficoltà diagnostiche gravano sull’inquadramento nosologico della patologia e influiscono negativamente anche sulla gestione della terapia, ancora non definita da protocolli standard. È intuibile che, per quanto riguarda le forme secondarie a fattori locali o sistemici, la terapia debba essere mirata contro la causa strutturale del bruciore.
Nelle forme neurologiche, ovvero idiopatiche, invece, le difficoltà nel decidere la corretta terapia sono maggiori e non sempre consentono di ottenere risultati soddisfacenti, perché richiedono il corretto inquadramento dello stato emotivo del paziente. È molto importante, prima di intraprendere la terapia, ottenere la collaborazione del paziente, informandolo e tranquillizzandolo sulla natura benigna della patologia, per ridurre l’apprensione e il livello d’ansia per motivarlo a intraprendere il lungo percorso terapeutico. Un passo fondamentale, infatti, è proprio quello di far comprendere chiaramente che, trattandosi di un disturbo a eziologia multifattoriale caratterizzato da una neuropatia periferica e centrale, il protocollo terapeutico, agendo su entrambe le disfunzioni, non potrà avere riscontri positivi immediati. Il trattamento farmacologico combinato mira a trattare la componente neuropatica centrale e quella periferica.
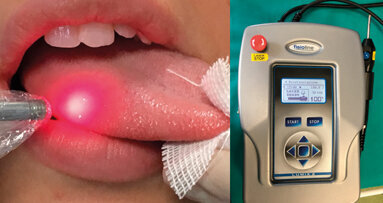
Il trattamento della neuropatia periferica viene effettuato inizialmente con collutori che aumentano l’umidificazione del cavo orale, oppure sostituti salivari; successivamente, in caso di mancata risposta terapeutica, si può prescrivere una terapia con benzodiazepine per uso topico, il farmaco maggiormente prescritto è il clonazepam25. Risultati molto soddisfacenti sono stati ottenuti anche con la Low Level Laser Therapy (LLLT) che, sfruttando le capacità biomodulanti dell’energia laser sul tessuto neuronale, si è dimostrata efficace nella gestione della sintomatologia, soprattutto in tutti i casi in cui non fosse presente una grave compromissione centrale24. La terapia della componente neuropatica centrale cerca di ristabilire un equilibrio di base negli stati di ansia spesso manifestati da questi pazienti, nonché ristabilire un corretto equilibrio nel ritmo sonno/veglia, che è uno degli indici di stress psicologico che più spesso si accompagna alla sintomatologia di base. Pertanto i farmaci maggiormente utilizzati sono farmaci selettivi per il sonno come la mirtazapina e il trazodone da soli o associati con inibitori del reuptake della serotonina (SSRI) o della serotonina e della noradrenalina (SNRI). Molti pazienti ottengono miglioramenti significativi associando un percorso psicoterapeutico prevalentemente di tipo cognitivo-comportamentale7.
Nella gestione della BMS, è comunque importante sottolineare come un approccio multidisciplinare che preveda la collaborazione di più specialisti (odontostomatologo, psichiatra, psicologo, neurologo e gastroenterologo) sia fondamentale per poter gestire e curare in maniera ottimale i vari aspetti di questa complessa patologia, sia per poter giungere quanto prima alla stesura di protocolli terapeutici standardizzati e facilmente attuabili, finalizzati a offrire una risposta davvero efficace alle sofferenze di questi pazienti.
Bibliografia
1. Grushka M, Sessle BJ. Burning mouth syndrome. Dent Clin North Am 1991;35(1):171- 84.
2. Spanemberg JC, Rodríguez de Rivera Campillo E, Salas EJ, López López J.Burning Mouth Syndrome: update. Oral Health Dent Manag. 2014 Jun;13(2):418-24.PubMed .
3. Scala A, Checchi L, Montevecchi M, Marini I, Giamberardino MA. Update on burning mouth syndrome: overview and patient management. Crit Rev Oral Biol Med 2003;14(4):275-91.
4. Zakrzewska JM, Forssell H, Glenny AM. Interventions for the treatment of burning mouth syndrome. Cochrane Database Syst Rev 2005;(1):CD002779.
5. Adamo D, Celentano A, Ruoppo E, Cucciniello C, Pecoraro G, Aria M, Mignogna MD. The Relationship Between Sociodemographic Characteristics and Clinical Features in Burning Mouth Syndrome. Pain Med. 2015 Nov.
6. Mignogna MD, Pollio A, Fortuna G, Leuci S, Ruoppo E, Adamo D, Zarrelli C. Unexplained somatic comorbidities in patients with burning mouth syndrome: a controlled clinical study. J Orofac Pain. 2011 Spring;25(2):131-40.
7. Grushka M, Epstein JB, Gorsky M. Burning mouth syndrome. Am Fam Physician 2002;65(4):615-20.
8. Maina G, Albert U, Gandolfo S, Vitalucci A, Bogetto F. Personality disorders in patients with burning mouth syndrome. J Pers Disord 2005;19(1):84-93.
9. Grushka M, Sessle BJ, Miller R. Pain and personality profiles in burning mouth syndrome. Pain 1987;28(2):155-67.
10. Maina G, Albert U, Gandolfo S, Vitalucci A, Bogetto F. Personality disorders in patients with burning mouth syndrome. J Pers Disord 2005;19(1):84-93.
11. Schiavone V, Adamo D, Ventrella G, Morlino M, De Notaris EB, Ravel MG, Kusmann F, Piantadosi M, Pollio A, Fortuna G, Mignogna MD. Anxiety, depression, and pain in burning mouth syndrome: first chicken or egg? Headache. 2012 Jun;52(6):1019-25.
12. Mignogna MD, Fedele S, Lo Russo L, Leuci S, Lo Muzio L. The diagnosis of burning mouth syndrome represents a challenge for clinicians. J Orofac Pain 2005;19(2):168-73.
13. Davies SJ, Underhill HC, Abdel-Karim A, Christmas DM, Bolea-Alamanac BM,Potokar J, Herrod J, Prime SS. Individual oral symptoms in burning mouth syndrome may be associated differentially with depression and anxiety. Acta Odontol Scand.2016 Mar;74(2):155-60.
14. Liu BL, Yao H, Zheng XJ, Du GH, Shen XM, Zhou YM, Tang GY. Low regional cerebral blood flow in burning mouth syndrome patients with depression. Oral Dis.2015 Jul;21(5):602-607.
15. Guimarães AL, de Sá AR, Victoria JM, de Fátima Correia-Silva J, Gomez MV, Gomez RS. Interleukin-1beta and serotonin transporter gene polymorphisms in burning mouth syndrome patients. J Pain. 2006 Sep.
16. Lauria G, Majorana A, Borgna M, Lombardi R, Penza P, Padovani A, et al. Trigeminal small-fiber sensory neuropathy causes burning mouth syndrome. Pain 2005;115(3):332-7.
17. Kolkka-Palomaa M, Jääskeläinen SK, Laine MA, Teerijoki-Oksa T, Sandell M, Forssell H. Pathophysiology of primary burning mouth syndrome with special focus on taste dysfunction: a review. Oral Dis. 2015 Nov;21(8):937-48.
18. Jääskeläinen SK, Forssell H, Tenovuo O. Abnormalities of the blink reflex in burning mouth syndrome. Pain 1997;73(3):455-60.
19. Hagelberg N, Forssell H, Rinne JO, Scheinin H, Taiminen T, Aalto S, et al. Striatal dopamine D1 and D2 receptors in burning mouth syndrome. Pain 2003;101(1-2):149-54.
20. Albuquerque RJ, de Leeuw R, Carlson CR, Okeson JP, Miller CS, Andersen AH. Cerebral activation during thermal stimulation of patients who have burning mouth disorder: an fMRI study. Pain 2006;122(3):223-34.
21. Sinding C, Gransjøen AM, Schlumberger G, Grushka M, Frasnelli J, Singh PB. Grey matter changes of the pain matrix in patients with Burning Mouth Syndrome. Eur J Neurosci. 2016 Jan.
22. Khan SA, Keaser ML, Meiller TF, Seminowicz DA. Altered structure and function in the hippocampus and medial prefrontal cortex in patients with burning mouth syndrome. Pain. 2014 Aug;155(8):1472-80.
23. Umezaki Y, Badran BW, DeVries WH, Moss J, Gonzales T, George MS. The Efficacy of Daily Prefrontal Repetitive Transcranial Magnetic Stimulation (rTMS) for Burning Mouth Syndrome (BMS): A Randomized Controlled Single-blind Study. Brain Stimul. 2016 Mar-Apr;9(2):234-42.
24. Romeo U, Del Vecchio A, Capocci M, Maggiore C, Ripari M. The low level laser therapy in the management of neurological burning mouth syndrome. A pilot study. Annali di Stomatologia. 2010;1(1):14-18.
25. Cui Y, Xu H, Chen F, Liu J, Jiang L, Zhou Y, Chen Q. Efficacy evaluation of clonazepam for symptom remission in burning mouth syndrome: a meta-analysis. Oral Dis. 2015 Dec 17.
L'articolo è stato pubblicato su Dental Tribune Italian Edition, giugno 2016.
Inquadramento clinico di una patologia cronica a eziologia sconosciuta, fortemente invalidante e di sempre maggior diffusione.
La Burning Mouth Syndrome (BMS) o sindrome della bocca urente, è una patologia cronica, a eziologia sconosciuta, fortemente invalidante e di sempre ...
Göteborg. Si sta chiarendo il quadro relativo al dolore cronico della bocca noto come “Sindrome della bocca urente” (BMS) che colpisce principalmente ...
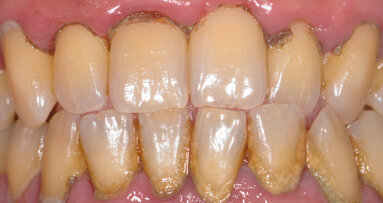
La parodontite aggressiva è una patologia che colpisce i tessuti parodontali superficiali e profondi portando alla progressiva perdita di attacco e ...
La parodontite aggressiva è una patologia che colpisce i tessuti parodontali superficiali e profondi portando alla progressiva perdita di attacco e ...
L’AIRO (Accademia Italiana Ricerca Orale), come sempre, è attenta alle correlazioni tra le sintomatologie del cavo orale e la salute sistemica....
L’AIRO (Accademia Italiana Ricerca Orale), come sempre, è attenta alle correlazioni tra le sintomatologie del cavo orale e la salute sistemica....
Per una buona pratica clinica di prevenzione è fondamentale una corretta interazione tra ergonomia, tecnologia ed efficaci protocolli operativi. La ...
Gli obiettivi principali di ogni trattamento professionale sono l’arresto della malattia in corso e il mantenimento della salute orale e della sua ...
Una volta una delle pandemie più diffuse era l’edentulismo, nel terzo millennio l’edentulismo è un fenomeno sempre più ...
Live webinar
mer. 11 marzo 2026
1:00 (CET) Rome
Dr. Vasiliki Maseli DDS, MS, EdM
Live webinar
mer. 11 marzo 2026
17:00 (CET) Rome
MDT Andreas Chatzimpatzakis
Live webinar
gio. 12 marzo 2026
17:00 (CET) Rome
Live webinar
mar. 17 marzo 2026
13:00 (CET) Rome
Live webinar
mar. 17 marzo 2026
18:00 (CET) Rome
Prof. Dr. Nadine Schlüter
Live webinar
mar. 17 marzo 2026
18:00 (CET) Rome
Dr. Giuseppe Luongo MD, DDS, Dr. Fabrizia Luongo DMD, MS
Live webinar
gio. 19 marzo 2026
0:00 (CET) Rome



 Austria / Österreich
Austria / Österreich
 Bosnia ed Erzegovina / Босна и Херцеговина
Bosnia ed Erzegovina / Босна и Херцеговина
 Bulgaria / България
Bulgaria / България
 Croazia / Hrvatska
Croazia / Hrvatska
 Repubblica Ceca e Slovacchia / Česká republika & Slovensko
Repubblica Ceca e Slovacchia / Česká republika & Slovensko
 Francia / France
Francia / France
 Germania / Deutschland
Germania / Deutschland
 Grecia / ΕΛΛΑΔΑ
Grecia / ΕΛΛΑΔΑ
 Ungheria / Hungary
Ungheria / Hungary
 Italia / Italia
Italia / Italia
 Paesi Bassi / Nederland
Paesi Bassi / Nederland
 nordisch / Nordic
nordisch / Nordic
 Polonia / Polska
Polonia / Polska
 Portogallo / Portugal
Portogallo / Portugal
 Romania e Moldavia / România & Moldova
Romania e Moldavia / România & Moldova
 Slovenia / Slovenija
Slovenia / Slovenija
 Serbia e Montenegro / Србија и Црна Гора
Serbia e Montenegro / Србија и Црна Гора
 Spagna / España
Spagna / España
 Svizzera / Schweiz
Svizzera / Schweiz
 Turchia / Türkiye
Turchia / Türkiye
 Gran Bretagna e Irlanda / UK & Ireland
Gran Bretagna e Irlanda / UK & Ireland
 Internazionale / International
Internazionale / International
 Brasile / Brasil
Brasile / Brasil
 Canada / Canada
Canada / Canada
 America Latina / Latinoamérica
America Latina / Latinoamérica
 USA / USA
USA / USA
 Cina / 中国
Cina / 中国
 India / भारत गणराज्य
India / भारत गणराज्य
 Pakistan / Pākistān
Pakistan / Pākistān
 Vietnam / Việt Nam
Vietnam / Việt Nam
 ASEAN / ASEAN
ASEAN / ASEAN
 Israel / מְדִינַת יִשְׂרָאֵל
Israel / מְדִינַת יִשְׂרָאֵל
 Algeria, Marocco e Tunisia / الجزائر والمغرب وتونس
Algeria, Marocco e Tunisia / الجزائر والمغرب وتونس
 Medio Oriente / Middle East
Medio Oriente / Middle East





















































To post a reply please login or register