Il cavo orale, con i suoi tessuti duri e molli, equivale a un ambiente variamente rappresentato. Esso risulta composto da numerosi micro ambienti ognuno dei quali con caratteristiche e habitat differenti. Esiste una stretta relazione tra i fattori fisiochimici legati all’ambiente, quali le superfici colonizzabili, la temperatura, il potenziale redox, il pH, e i fattori legati all’ospite, quali il flusso salivare, il fluido crevicolare, il livello di igiene orale domiciliare.
Attualmente si apprezza l’importanza dell’assioma secondo il quale i microrganismi influiscono sull’ambiente e l’ambiente influisce sui microrganismi. Le superfici colonizzabili da parte del biofilm orale sono numerose, alcune di queste forniscono ai microrganismi facili rifugi favorendo la loro persistenza a bassi livelli, anche dopo la terapia parodontale antinfettiva.
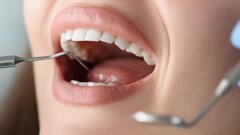
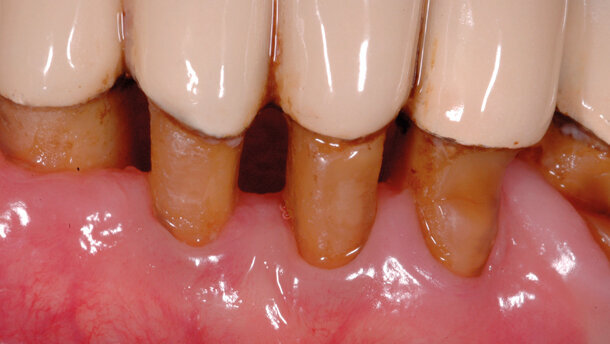
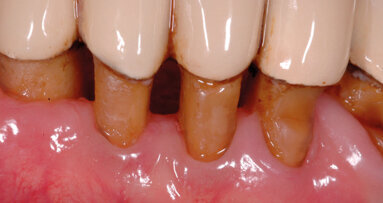
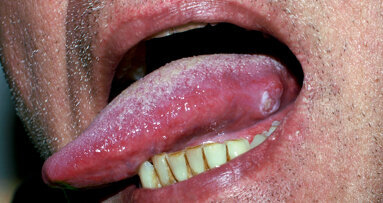
Tali microrganismi possono riemergere e colonizzare i siti trattati determinando l’insuccesso delle terapie. Le superfici sono rappresentate sia dalle mucose, come dimostrato dai lavori di Socransky e Haffajee1, sia dai tessuti duri con aspetto anfrattuoso (restauri debordanti, superfici radicolari esposte) (Fig. 1). Il dorso linguale risulta essere un habitat favorevole per i batteri. Fornisce infatti aree con ridotto apporto di ossigeno a causa della presenza delle numerose papille.
Le papille sono piccole strutture di varia forma di origine neuroepiteliale. Originano dalla lamina propria della mucosa e sono ricoperte dall’epitelio di rivestimento (Figg. 2-4). Là dove l’anatomia linguale presenta fissurazioni (lingua fissurata, lingua a carta geografica) vi sono solchi profondi anche diversi millimetri; si possono instaurare quindi condizioni di anaerobiosi, favorenti lo sviluppo delle specie batteriche patogene (Figg. 5a, 5b).
Numerosi studi in letteratura evidenziano la dannosa sinergia tra la malattia parodontale e l’alitosi2-4.
Le tasche parodontali non trattate, veri e propri serbatoi batterici, rappresentano insieme alla superficie linguale la principale fonte di gas maleodoranti: i cosiddetti composti volatili solforati, VSC.
Per “alitosi” si intende cattivo odore emesso dal cavo orale indipendentemente dalla sede da cui trae origine. Per “oral malodor” si intende alitosi di origine esclusivamente orale.
L’alitosi è un problema piuttosto diffuso, tanto che circa il 50% della popolazione può manifestarla5.
L’origine dell’alitosi è dato da:
- 90% dal cavo orale;
- 9% dalle vie respiratorie (a causa di sinusite, bronchite, polmonite); apparato digerente; apparato urinario; diabete (chetoacidosi diabetica); cirrosi epatica;
- per l’1% da dieta e assunzione di farmaci6.
Nell’ambito delle cause dell’alitosi orale il coating linguale è il responsabile al 51%, il restante 49% da gengivite e malattia parodontale. Nei pazienti affetti da parodontite, la presenza di coating linguale è stata riscontrata sei volte maggiore rispetto ai pazienti con salute parodontale7. La lingua possiede la più alta carica batterica rispetto agli altri tessuti orali.
La sede principale del cavo orale dove vengono prodotti i VSC si ritiene che sia il dorso linguale posteriore (Fig. 6).
Il coating linguale, che è in continua formazione, è composto da residui alimentari, batteri morti e vivi, cellule epiteliali desquamate7.
Analizzando questi dati possiamo facilmente concludere che la maggior parte della risoluzione del problema dell’alitosi è di competenza dell’odontoiatra e dell’igienista dentale.
L’alitosi intraorale è associata alla degradazione batterica di aminoacidi contenenti zolfo (metionina, cisteina, cistina) in composti volatili solforati, VSC.
I principali VSC sono:
- il metilmercaptano, o MM (CH3SH), la cui sensazione odorosa è di cavolo marcio, pungente. Esso è correlato ai tessuti parodontali infetti;
- l’idrogeno solforato (H2S), la cui sensazione odorosa è di uova marce, è correlato alla presenza del coating linguale;
- il dimetilsolfuro (CH3SCH3), la cui sensazione odorosa è dolce, sgradevole, è correlato a patologie gastrointestinali e diabete non compensato7.
La formazione dei VSC è data dall’attività dei batteri Gram negativi proteolitici quali principalmente Porphyromonas gingivalis, Treponema denticola, Prevotella intermedia e Fusobacterium nucleatum. Anche batteri Gram positivi (Peptostreptococcus) in vitro hanno dimostrato tale capacità. Occorre quindi distinguere tra alitosi di pazienti con storia di malattia parodontale e pazienti senza storia di malattia parodontale7.
Nei pazienti con malattia parodontale il metilmercaptano (MM) è stato riscontrato come il VSC più abbondante. Il MM altera la permeabilità dei tessuti gengivali maggiormente rispetto al H2S. Il MM agisce inoltre in sinergia con gli LPS batterici e con l’interleuchina 1-Beta andando ad aumentare la produzione di prostaglandina E2 e di collagenasi, questi ultimi importanti mediatori del processo infiammatorio e della distruzione tissutale7-8.
Nelle forme di parodontite aggressiva, parodontite necrotizzante e nella gengivite necrotizzante l’alitosi risulta amplificata.
Un altro importante fattore precedentemente citato è il flusso salivare. L’intensità dei VSC è aumentata nel caso di flusso salivare ridotto, xerostomia9, in quanto vengono a mancare in tutto o in parte l’effetto tampone, l’azione di autodetersione e l’azione degli enzimi salivari che contribuiscono a mantenere l’omeostasi del cavo orale.
La riduzione del flusso salivare può essere determinata da farmaci come antidepressivi, ansiolitici, diuretici, ACE-inibitori, e da patologie quali la Sindrome di Sjogren10 nonché da terapie radianti nel distretto capo-collo.
Valutazione dell’alitosi
Per quello che riguarda la valutazione dell’alitosi può essere effettuata con misurazione organolettica o con l’ausilio di apparecchiature dedicate, OralChroma™ oppure Halimeter™, rilevanti la presenza e il quantitativo in ppb (parts per billion) dei principali VSC.
La misurazione organolettica è il metodo più economico, veloce, semplice e attuabile a livello ambulatoriale in quanto consiste nell’odorare, da parte dell’operatore, l’aria espirata dalla bocca e dal naso del paziente e dare a tale espirazione uno score7 (Tab. 1).
Tuttavia questo metodo presenta alcune lacune, risulta infatti difficoltoso standardizzare il giudizio dell’operatore in modo ripetibile e sovrapponibile nel tempo.
Prima di sottoporsi alle valutazioni organolettiche o ai test strumentali, il paziente non deve:
- assumere antibiotici nelle 8 settimane prima della valutazione;
- assumere alcool o fumare nelle 12 ore precedenti;
- assumere cibi con cipolla e aglio nelle 48 ore precedenti al test;
- mangiare o bere nelle 8 ore precedenti al test.
Si può solamente bere acqua 3 ore prima dell’esame. Astenersi da applicare manovre di igiene orale domiciliare la mattina del test, come anche non utilizzare cosmetici in quanto le loro fragranze potrebbero disturbare la percezione degli odori da parte dell’operatore.
Per la misurazione organolettica viene chiesto al paziente di tenere la bocca chiusa per un minuto e successivamente di espirare l’aria dalla bocca attraverso una pipetta, quest’ultima consente una maggiore intensità dell’aria esalata. L’operatore si pone a distanza di 20 cm esaminando con l’olfatto l’espirazione del paziente e annotando il corrispettivo score percepito11 (Tab. 1). La misurazione dell’alitosi con la gascromatografia risulta essere a oggi lo standard di riferimento in quanto è un metodo oggettivo, preciso, riproducibile e attendibile; tuttavia è una modalità diagnostica costosa e non è utilizzata comunemente nell’ambito di uno studio professionale12.
L’apparecchiatura per eseguire la gascromatografia è OralChroma™ che permette la misurazione digitale dei tre principali VSC (metilmercaptano, idrogeno solforato, dimetilsolfuro) da un campione di aria espirata. I risultati vengono forniti visivamente sotto forma di grafici attraverso l’interfaccia di un computer.
Per l’esecuzione pratica del test OralChroma™ si chiede di inserire una siringa monouso da 10 ml (privata dell’ago) nel cavo orale senza toccare con la lingua la sua estremità (non deve entrare saliva), si chiede di tenere le labbra serrate per 30 secondi poi l’operatore tira lo stantuffo prelevando l’aria dal cavo orale stesso.
A questo punto, si collega l’ago alla siringa e si immette l’aria contenuta nell’apposito foro presente sul gascromatografo. Dopo 8 minuti di elaborazione dati vengono forniti i risultati sotto forma di grafici riportanti le concentrazioni dei vari VSC.
Altro esame strumentale è il monitoraggio dei solfuri mediante l’apparecchio portatile Halimeter™, estremamente sensibile all’idrogeno solforato ma meno sensibile al metilmercaptano e dimetilsolfuro. Quest’ultimo è un VSC da alitosi extraorale7. Con il test strumentale Halimeter™ si può analizzare sia l’aria espirata dal naso sia quella espirata dalla bocca.
La cannuccia monouso viene portata verso la narice del paziente e gli viene chiesto di soffiare lentamente. Viene dunque registrato il valore in ppb. Successivamente si chiede al paziente di chiudere la bocca per un minuto, poi di aprirla sporgendo la lingua. Si colloca la cannuccia sulla porzione medioposteriore della lingua e la si lascia fino a quando la registrazione è ultimata.
I valori di riferimento in caso di assenza di alitosi possono variare da 80 a 110 ppb. In caso di alitosi i valori superano i 160 ppb7.
Trattamento professionale
Una corretta diagnosi è essenziale per il raggiungimento del successo terapeutico. Qualora il paziente presenti forme più o meno severe di malattia parodontale, oppure di gengivite, il primo approccio è sempre la terapia parodontale modulata in base alla gravità della malattia stessa. Con la terapia parodontale si vanno a rimuovere i fattori eziologici della distruzione tissutale, microrganismi come il Porphyromonas gingivalis che vive in tasche profonde ed è uno dei maggiori produttori di MM. Nell’ambito delle procedure terapeutiche vengono rimossi i patogeni parodontali e il tartaro. La presenza di depositi duri risulta essere un fattore favorente per la proliferazione batterica sottogengivale.
Per eliminare l’alitosi è necessario che la terapia parodontale sia adeguata alla gravità clinica. Una singola sessione di profilassi orale comprendente istruzioni di igiene orale domiciliare, con particolare attenzione alla pulizia della lingua, è sufficiente nei pazienti senza malattia parodontale ma insufficiente nei pazienti con malattia parodontale che vanno trattai in base alle loro esigenze cliniche13-15. Durante il trattamento parodontale occorre somministrare sciacqui con clorexidina al fine di completare la riduzione della carica microbica.
La pulizia del dorso linguale assume importanza fondamentale nel controllo dei VSC. La loro diminuzione raggiunge il 33% con il solo spazzolamento degli elementi dentari e il 42% con la sola detersione della lingua15,16. È stato dimostrato che la detersione della lingua, eseguita nell’ambito dell’igiene orale serale, riduce efficacemente l’alitosi del mattino7. Lo strumento che risulta maggiormente adatto alla pulizia del dorso linguale è il raschietto linguale: più efficace dello spazzolino e meno traumatico7. I filamenti dello spazzolino tendono a trattenere residui batterici, mentre il raschietto linguale è stato realizzato con un materiale e un disegno dedicato appositamente per la rimozione del coating nel rispetto delle papille linguali (Figg. 7a, 7b). Come precedentemente descritto è soprattutto la porzione posteriore del dorso linguale a essere rivestito da patina, il raschietto può essere delicatamente adagiato sul terzo posteriore e portato verso l’apice della lingua alcune volte (Figg. 8a-8c).
Nei pazienti affetti da alitosi grave la prescrizione della pulizia linguale è di cinque passaggi due volte al giorno7 questa procedura andrà a rimuovere il substrato di putrefazione. Unitamente alla rimozione meccanica della patina linguale, l’utilizzo di un collutorio contenente clorexidina + cetilpiridino cloruro (CHX 0,05 % + CPC 0,05 %) fornisce buoni risultati nella riduzione dei VSC7,17-19.
Il cetilpiridinio cloruro rappresenta un agente efficace per la riduzione dell’alitosi, inibendo la crescita dei microrganismi e sopprimendo l’espressione dei geni specifici relativi alla produzione di VSC in patogeni parodontali anaerobi18,20.
La condizione di alitosi nelle sue varie forme (intraorali, extra orali, più o meno severe) può risultare altamente invalidante per la vita di relazione dell’individuo che ne è affetto, fino a portare a un vero e proprio isolamento sociale con conseguente ripercussione sulla salute psico-fisica del soggetto stesso.
L’odontoiatra e l’igienista dentale sono le figure professionali che possono maggiormente intervenire nel riportare, con le loro terapie, la salute del cavo orale restituendo al paziente una gratificante vita di relazione.
embedImagecenter("Imagecenter_1_1716",1716, "large");
Bibliografia
1. Socransky, S.S & Haffajee, A.D. (2005). Periodontal microbial ecology. Periodontology 2000 38, 135-187.
2. Cortelli JR, Barbosa MD, Westphal MA. Halitosis: A review of associated factors and therapeutic approach. Brazilian oral research 2008; 22:44-54.
3. Soder B, Johansson B, Soder PO. The relation between foetor ex ore, oral hygiene and periodontal disease. Swedish dental Journal. 2000;24:73-82.
4. Nakano Y, Yoshimura M, Koga T,. Correlation between oral malodor and periodontal bacteria. Microbes and infection/Institute Pasteur 2002;4:679-83.
5. Nanchnani S. Oral malodor: Causes, assessment, and treatment. Compend Contin Educ Dent 2011; 32:22-24, 26-28.
6. Scully C, Porter S, Greenman J. What to do about halitosis. BMJ. 1994-01-22 00:00:00 1994;308:217-18.
7. Controllo dell’alitosi, Edwin G. Winkel. Parodontologia Clinica e Implantologia Orale. Jan Lindhe V ed.
8. Takeuchi H, Machigashira M, Yamashia D, et al. The association of periodontal disease with oral malodour in a Japanese population. Oral disease 2010; 16:702-6.
9. Koshimune S, Awano S, Gohara K, Kurihara E, Ansai T. Low salivary flow and volatile sulfur compunds in mouth air. Oral Surgey, Oral Medicine, Oral Pathology, Oral Radiology and Endodontology. 2003;96:38-41.
10. Kleinberg I, Wolff Ms, Codipilly Dm. Role of saliva in oral dryness, oral feel and oral malodour. International dental journal 202;52:236-40.
11. Yaegaki K, Coil JM. Examination, classification, and treatment of halitosis; clinical perspectives. J can Dent Assoc. May 2000;66:257-61.
12. Murata T, Yamaga T, Iida T, Miyazaki H, Yeagaki K. Classification and examination of halitosis. International dental journal 2002;52:181-6.
13. A Guentsch, W Pfister, G Cachovan, G Raschke. Oral prophylaxis and its effects on halitosis associated and inflammatory parameters in patients with chronic periodontitis. International Journal Dental Hygine 2014- 12:199-207.
14. Klokkevold PR. Oral malodor: A periodontal prospective. Journal of the California dental Association 1997;25:153-9.
15. Seemann R, Kison A, Bizhang M, Zimmer S. Effectivness of mechanical tongue cleaning on oral levels of volatile sulfur compounds. J Am Dent Assoc 2001;132:1263-7.
16. Kuo YW, Yen M, Fetzer S, Lee JD. Toothbrushing versus toothbrushing plus tongue cleaning in reducing halitosis and tongue coating: a systemic review and meta-analysis. Nurs Res.201362:422-9.
17. Fedorowicz Z, Aliufairi H, Nasser M. Mouthrinses for the treatment of halitosis. Chocrane Database Syst Rev. 2008 (;(4): CD006701.
18. Liu J, Ling JQ, Wu CD.Cetylpyridinium chloride suppsses gene expression associated with halitosis. Arch Oral Biol. 2013 58(11):1686-91.
19. Blom T, Slot DE, Quirynen M, Van der Weijden GA. The effect of mouthrinses on oral malodor: a systematic review. Int J Dent Hyg. 2012 Aug; 10:209-22.
20. Stookey GK, Beiswanger B, Mau M. A 6-month clinical study assessing the safety and efficacy of two cetylpyridinium chloride mouthrinses. Am J Dent. 2005 Jul;18 Spec No:24A-28A.
L'articolo è stato pubblicato sullo speciale Hygiene Tribune Italian Edition, aprile 2014.
Il cavo orale, con i suoi tessuti duri e molli, equivale a un ambiente variamente rappresentato. Esso risulta composto da numerosi micro ambienti ognuno dei...
LUSSEMBURGO – Avere un’elevata proporzione di dentisti attivi non ha messo i Paesi dell’UE al riparo dalle disuguaglianze nelle cure odontoiatriche. ...
La richiesta di trattamenti estetici è in aumento, sia in Italia che nel resto del mondo, anche tra i più giovani. Questo trend è dovuto a diversi ...
Si è svolto a Bologna, il 21 e 22 novembre 2025, il 35° Congresso Nazionale AIDI.
La digitalizzazione nel settore dentale è inarrestabile, annuncia il cambiamento e offre un enorme potenziale. Molti odontotecnici e dentisti vogliono ...
Cleveland. Le nuove scoperte di un team di ricerca statunitense su batteri e funghi potrebbero aprire la strada allo sviluppo di un test precauzionale per ...
Jalupro è un sistema integrato di prodotti per la cura e la rigenerazione cutanea, pensato per contrastare i principali segni dell’invecchiamento. ...
Le perimplantiti e la loro gestione, come dimostrato dai più recenti lavori pubblicati in letteratura e dalle relative revisioni, si configurano come...
CAMBRIDGE, Mass, USA: La carie dentale, una delle malattie orali più comuni in tutto il mondo, è prevalentemente causata dal batterio ...
New York, Stati Uniti: Secondo uno studio condotto presso la Columbia University, il danno causato dai batteri si diffondono nel corpo e hanno un'influenza ...
Live webinar
mer. 4 marzo 2026
18:00 (CET) Rome
Munther Sulieman LDS RCS (Eng) BDS (Lond) MSc PhD
Live webinar
mer. 4 marzo 2026
19:00 (CET) Rome
Live webinar
gio. 5 marzo 2026
2:30 (CET) Rome
Lancette VanGuilder BS, RDH, PHEDH, CEAS, FADHA
Live webinar
ven. 6 marzo 2026
9:00 (CET) Rome
Live webinar
lun. 9 marzo 2026
17:30 (CET) Rome
Live webinar
lun. 9 marzo 2026
20:00 (CET) Rome
Live webinar
mar. 10 marzo 2026
9:00 (CET) Rome
Assoc. Prof. Aaron Davis, Prof. Sarah Baker



 Austria / Österreich
Austria / Österreich
 Bosnia ed Erzegovina / Босна и Херцеговина
Bosnia ed Erzegovina / Босна и Херцеговина
 Bulgaria / България
Bulgaria / България
 Croazia / Hrvatska
Croazia / Hrvatska
 Repubblica Ceca e Slovacchia / Česká republika & Slovensko
Repubblica Ceca e Slovacchia / Česká republika & Slovensko
 Francia / France
Francia / France
 Germania / Deutschland
Germania / Deutschland
 Grecia / ΕΛΛΑΔΑ
Grecia / ΕΛΛΑΔΑ
 Ungheria / Hungary
Ungheria / Hungary
 Italia / Italia
Italia / Italia
 Paesi Bassi / Nederland
Paesi Bassi / Nederland
 nordisch / Nordic
nordisch / Nordic
 Polonia / Polska
Polonia / Polska
 Portogallo / Portugal
Portogallo / Portugal
 Romania e Moldavia / România & Moldova
Romania e Moldavia / România & Moldova
 Slovenia / Slovenija
Slovenia / Slovenija
 Serbia e Montenegro / Србија и Црна Гора
Serbia e Montenegro / Србија и Црна Гора
 Spagna / España
Spagna / España
 Svizzera / Schweiz
Svizzera / Schweiz
 Turchia / Türkiye
Turchia / Türkiye
 Gran Bretagna e Irlanda / UK & Ireland
Gran Bretagna e Irlanda / UK & Ireland
 Internazionale / International
Internazionale / International
 Brasile / Brasil
Brasile / Brasil
 Canada / Canada
Canada / Canada
 America Latina / Latinoamérica
America Latina / Latinoamérica
 USA / USA
USA / USA
 Cina / 中国
Cina / 中国
 India / भारत गणराज्य
India / भारत गणराज्य
 Pakistan / Pākistān
Pakistan / Pākistān
 Vietnam / Việt Nam
Vietnam / Việt Nam
 ASEAN / ASEAN
ASEAN / ASEAN
 Israel / מְדִינַת יִשְׂרָאֵל
Israel / מְדִינַת יִשְׂרָאֵל
 Algeria, Marocco e Tunisia / الجزائر والمغرب وتونس
Algeria, Marocco e Tunisia / الجزائر والمغرب وتونس
 Medio Oriente / Middle East
Medio Oriente / Middle East


















































To post a reply please login or register